-
日本落叶松(Larix kaempferi (Lamb.) Carr.)为松科(Pinaceae)落叶松属(Larix)乔木,广泛分布于温带和寒温带等地区。它是我国重要的用材树种,具有早期速生、病虫害少、轮伐期短、成林快、抗逆性强等特点。基于有性繁殖的落叶松传统育种存在优良性状难以保持、生长周期长等问题极大地限制着日本落叶松优异种质资源的大规模利用。和扦插、嫁接相比,日本落叶松体细胞胚胎发生技术具有遗传稳定性强、繁殖系数高等优点,已成为当前最有潜力的无性繁殖技术,受到越来越多的关注[1-6]。
体细胞胚胎发生(Somatic embryogenesis)是指体细胞经历脱分化并在体外形成类似胚胎的胚状体,这一过程与合子胚的发育过程有许多相似之处[7-8]。在1987年von Aderkas以杂种落叶松(L. ecidua × L. leptolepis)雌配子体为外植体诱导出胚性愈伤,但未获得再生植株[9]。Klimaszewska以欧日杂种落叶松(Larix × eurolepis)未成熟种子为外植体,成功培育出再生植株[10]。此后体细胞胚胎发生技术在多种杂种落叶松[11-12]、华北落叶松(L. gmelinii var. principis-rupprechtii (Mayr) Pilger)、西伯利亚落叶松(L. sibirica Ledeb.)[13-14]、长白落叶松(L. olgensis Henry)[15-16]和日本落叶松[17-18]等落叶松中都得以应用并取得一定的进展,但依然存在一些问题亟待解决,比如胚状体萌发率和成苗转化率低等,这些问题限制了日本落叶松体胚发生技术的发展和应用。
在萌发培养前对胚状体进行干化处理是解决上述问题的一种可行的方法。干化处理可以将“形态成熟”的胚状体转化成“生理成熟”的胚状体,从而促进萌发[19-20]。这在云杉属(Picea)体细胞胚胎发生技术体系中得到很好的应用,被认为是体细胞胚成功萌发的先决条件[21-22],但在日本落叶松体细胞胚胎发生技术体系中尚未见到过相关的研究和应用报道。
本研究以日本落叶松胚状体为材料,观察并统计不同类别胚状体的萌发情况,探究干化处理对日本落叶松胚状体萌发的影响,旨在提高日本落叶松胚状体的萌发率,促进日本落叶松高效稳定再生体系的建立,为日本落叶松良种繁育和规模化应用提供技术支撑。
-
本实验以日本落叶松C6细胞系为材料,所用到的增殖培养基、成熟培养基和萌发培养基均参考齐力旺的方法[23]。培养基pH为5.8,121 ℃高压灭菌后,在无菌环境下分装备用。增殖培养和成熟培养在暗环境(温度22 ℃)下进行,萌发培养先在暗环境下进行3 d,之后在光环境(温度24 ± 2 ℃,光照14 h,光照强度1 000 lx)下进行。
-
胚性愈伤组织成熟培养45 d后,随机选取100个胚状体,根据子叶数量和胚轴形态进行形态分类,显微镜下观察、分类、拍照,统计不同类别胚状体的发生频率。成熟培养共进行4次,共分析400个胚状体。
-
重新选取300个胚状体进行分类与萌发培养。2个月后统计其萌发情况。观察到子叶伸长、胚轴生长和胚根伸长,分别用“√”标记,反之,用“ × ”标记,培养条件同上。
-
类型Ⅰ胚状体采用“滤纸容器法”进行干化处理[24]。处理时,用镊子将胚状体平铺在有3层干滤纸(70 mm)的塑料培养皿(90 mm × 20 mm)中,随后再将无盖的塑料培养皿放在装有15 mL去离子水的玻璃培养皿(180 mm × 31 mm)中;玻璃培养皿用封口膜封口,随后放置在光环境下(温度24 ± 2 ℃,光照14 h,光照强度1 000 lx)。干滤纸、培养皿和去离子水在使用前进行高压灭菌。干化处理分别进行0、7、14、21和28 d。每次处理后取180个胚状体放入萌发培养基中,每皿60个,重复3次,30 d后统计其萌发情况。
-
本实验以子叶和胚轴伸长、胚根长出作为胚状体萌发的标准。
y=(n/N)×100%
式中:y为胚状体萌发率,n为萌发的胚状体数量,N为参与萌发培养的胚状体数量。采用软件IBM SPSS Statistics19.0进行方差分析。
-
日本落叶松C6胚性愈伤组织经过成熟培养后产生形态各异的胚状体。进一步观察和分析后,胚状体可分为10种类型(图1、表1),其中类型I发生频率最高,达到56.75%;类型Ⅲ、类型Ⅵ发生频率分别为12.75%、13.25%,仅次于类型I;其余类型的发生频率较低,都不足5%。
分类
Classification子叶数量
Number of
cotyledon (NC)胚轴形态
Hypocotyl
shape发生频率/%
FrequencyI 4≤NC≤10 匀称 56.75 II 4≤NC≤10 无 4.75 Ⅲ 4≤NC≤10 膨大 12.75 Ⅳ 0≤NC<4 匀称 2.50 Ⅴ 0≤NC<4 无 1.25 Ⅵ 0≤NC<4 膨大 13.25 Ⅶ NC>10 匀称 1.00 Ⅷ NC>10 无 1.25 Ⅸ NC>10 膨大 2.75 Ⅹ — — 3.75 注:“—”表示不能分析
Note: “—” indicates no analysisTable 1. Morphology and classification of Larix kaempferi embryoids
-
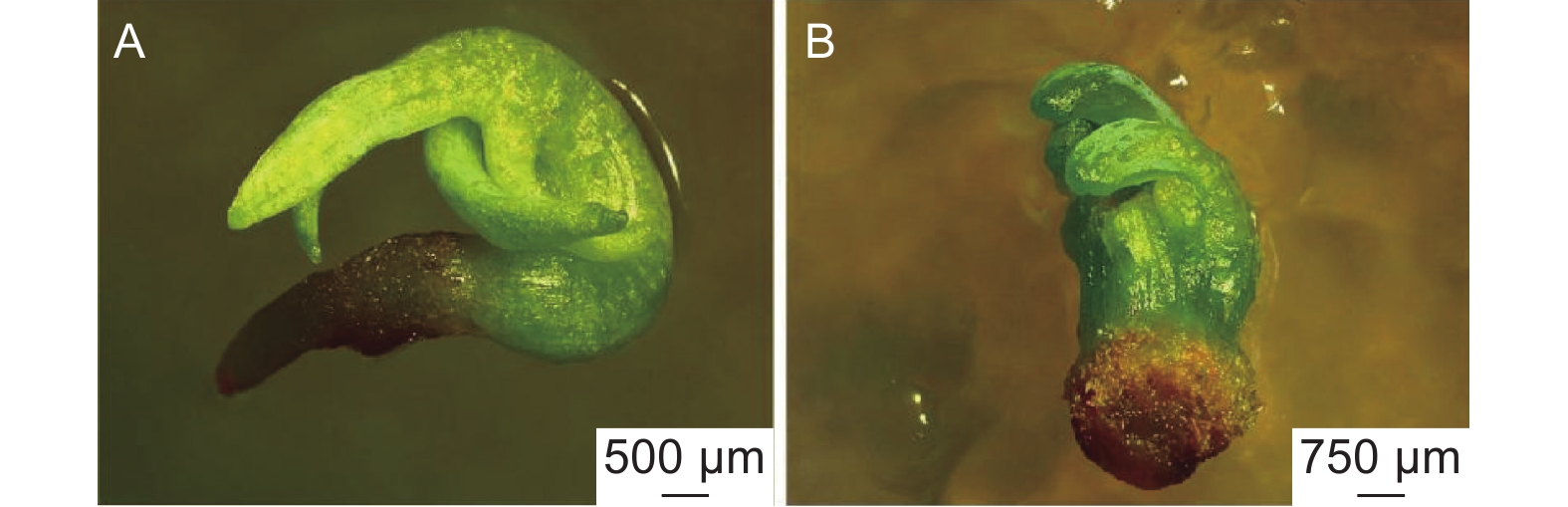
在萌发培养基上,随机挑选的淡黄色胚状体先在暗环境下培养3 d,之后在光环境下培养。7 d左右观察到胚状体发生膨大,子叶变绿。12 d左右子叶变成翠绿色、胚轴伸长。随后,部分胚状体长出红色根尖(图2)。
类型Ⅰ胚状体萌发培养5 d后,子叶由黄变绿,胚状体开始膨大;10 d后子叶变成翠绿色,子叶和胚轴伸长,基部产生微小的红色根尖(图2A),萌发率为4.48%。类型Ⅹ的胚状体在萌发培养过程中会慢慢褐化死亡。其它8种类型的胚状体都表现出子叶伸长,部分胚状体有胚轴生长,但均未见胚根生长(表2,图2B)。
分类
Classification子叶伸长
Cotyledon
elongation胚轴生长
Hypocotyl
growth胚根生长
Radicle
growthI √ √ √ II √ × × Ⅲ √ × × Ⅳ √ √ × Ⅴ √ × × Ⅵ √ × × Ⅶ √ √ × Ⅷ √ × × Ⅸ √ × × Ⅹ × × × Table 2. Germination of Larix kaempferi embryoids
-
在萌发培养过程中,仅类型Ⅰ胚状体表现出完整的萌发性状,因此用类型Ⅰ胚状体进行干化处理。与未干化处理的胚状体相比,干化处理7、14、21和28 d的胚状体萌发率均有增加,其中干化处理14 d的胚状体萌发率最高,达到69.43%(表3,图3),说明干化处理可以显著促进胚状体萌发。
干化天数
Desiccation time/d萌发率
Germination rate/%0 5.57 ± 0.98 d 7 25.00 ± 6.03 c 14 69.43 ± 12.61 a 21 38.90 ± 6.97 bc 28 48.87 ± 10.86 b 注:不同字母表示P <0.05水平差异显著
Note: Different letters indicate a significant difference at P <0.05 level (LSD)Table 3. Effect of desiccation on the germination of Larix kaempferi embryoids
-
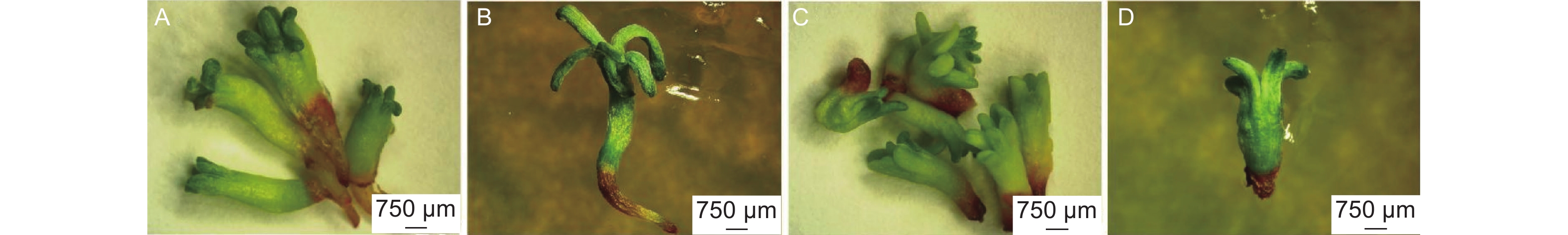
在干化处理过程中,胚状体的颜色有两种变化,一种是子叶、胚轴变绿,胚根变红(图4A),另一种是子叶、胚轴颜色无明显变化,胚根微微变红(图4B、C)。参考粗枝云杉胚状体干化处理后的分类标准[24],将子叶和胚轴变绿、胚根变红的日本落叶松胚状体称为有干化响应的胚状体,将另外一种胚状体称为无干化响应的胚状体。
进一步分析发现,有干化响应的胚状体更易萌发。所有经过干化处理的720个胚状体中,有干化响应的胚状体共有649个(90.1%),其中有317个(48.8%)萌发;无干化响应的胚状体共有71个,但仅有11个(15.5%)萌发。干化处理14 d,有干化响应的胚状体162个(90%),其中122个(75.3%)萌发,而无干化响应的胚状体18个(10%),只有3个(16.7%)萌发(表4)。因此,可以将干化响应作为挑选胚状体进行萌发培养的依据。
干化天数
Desiccation
time/d有干化响应的胚状体
Embryoids with
desiccation response无干化响应的胚状体
Embryoids without
desiccation response数量
Number萌发数量
Germination
number数量
Number萌发数量
Germination
number7 165 43 15 2 14 162 122 18 3 21 157 66 23 4 28 165 86 15 2 Table 4. Desiccation response and germination of somatic embryos
-
在日本落叶松体细胞胚胎发生过程中,胚性愈伤组织经历增殖培养和成熟培养后会产生形态各异的胚状体,这些胚状体的萌发能力存在差异。齐力旺[23]在研究华北落叶松过程中发现,子叶数量少、胚轴短的胚状体都难以萌发。李哲馨等对日本落叶松胚状体按照子叶数量进行了分类,发现子叶数量多于或等于4个的胚状体的萌发率高于其它类别的胚状体[25]。上述工作表明,先对胚状体进行分类而后进行萌发培养有助于提高萌发率和工作效率。本研究首先按照子叶数量和胚轴形态对日本落叶松胚状体进行了更为细致的分类,发现它们可以分为10种类型;随后进行了萌发培养,发现仅有类型I胚状体可以萌发,萌发率为4.48%,其余类型胚状体都难以萌发。以往对胚状体进行分类多以子叶数量为依据[25-27],本研究以子叶数量和胚轴形态作为分类的依据,使分类标准更加细化与完善。
在萌发培养过程中,仅部分类型Ⅰ胚状体表现出完整的萌发性状,子叶伸长、变绿,胚轴伸长,胚状体下端长出胚根,而其余类型胚状体未长出胚根。推测部分类型Ⅰ胚状体的根端发育相对完善,而其它类型胚状体的根端发育异常。这些结果表明,胚状体形态结构的完整性决定着它们是否可以萌发。研究结果也进一步说明在萌发培养前对胚状体进行形态分类,有助于挑选出适宜进行萌发培养的胚状体。
胚状体“生理成熟”是萌发的关键前提,而干化处理可以使胚状体达到生理成熟、促进其萌发[19-20]。Jing等在云杉研究中发现,萌发率随着干化时间呈现上升趋势,干化处理14 d萌发率最高[28]。Maruyama等在日本黑松(Pinus thunberghii Parl.)和日本赤松(P. densiflora Siebold & Zucc.)研究中同样发现,干化处理可以显著提高萌发率[29]。本研究发现,未经干化处理的类型I胚状体萌发率为5.57%,而干化处理14 d后萌发率提高了63.86%,说明干化处理可以显著提高日本落叶松类型I胚状体的萌发率。由于未经干化处理的其余类型胚状体萌发培养后未表现出完整的萌发性状,本研究未对其进行干化处理。因此,干化处理是否可以使这些胚状体达到生理成熟,进而促进其萌发,还需进一步确定。
即使是类型I胚状体,在干化处理后也表现出不同的性状。其中子叶、胚轴变绿,胚根变红的胚状体,被称为有干化响应的胚状体;子叶、胚轴颜色无明显变化,胚根微微变红的胚状体,被称为未有干化响应的胚状体。进一步研究发现,具有干化响应的类型I胚状体比无干化响应的类型I胚状体更易萌发,这与粗枝云杉胚状体(Picea asperata Mast)干化处理的研究结果一致[24]。据此,推测无干化响应的类型I胚状体根端发育不完善,而具有干化响应的类型I胚状体根端发育相对完善。由此可知,类型I胚状体内部结构也存在差异,且这些差异可以通过干化响应表现出来。因此对类型I胚状体进行干化处理,有助于进一步挑选更适宜进行萌发培养的胚状体。
-
基于上述研究结果,建议挑选子叶数量多于4、胚轴匀称的日本落叶松胚状体进行干化处理。干化处理14 d的胚状体萌发率提高了63.86%,且具有干化响应的胚状体更易萌发。研究结果有助于促进体细胞胚胎发生技术在日本落叶松遗传育种中的应用,也为其它针叶树繁育技术的研发和完善提供参考。
Effect of Desiccation on Germination of Larix kaempferi Embryoids
- Received Date: 2023-08-10
- Accepted Date: 2024-01-04
- Available Online: 2024-04-27
Abstract:










 DownLoad:
DownLoad: