-
蒙古栎(Quercus mongolica Fisch. ex Ledeb.)为壳斗科(Fagaceae)栎属落叶乔木,广泛分布于我国东北和华北地区,是落叶栎类中最耐寒和耐旱树种,具有较高的生态和经济价值[1]。生产中,蒙古栎多以种子进行播种繁殖,致使优良性状不能稳定遗传,林分质量得不到保证,无法形成高经济价值林木,进而影响蒙古栎开发利用和产业化进程[2]。
无性繁殖是树木良种规模化推广的重要途径,其中扦插应用最广泛。插穗能否生根是决定扦插成功的关键。栎树插穗内含有大量酚类等阻碍生根的物质,属于极难生根树种[3]。植物生长调节剂能显著促进栎树插穗生根。例如:栓皮栎(Quercus variabilis Blume)插穗经1 000 mg·L−1 IBA速蘸处理后,生根率可达34.07%,比对照组提高5.2倍[4];北美红栎(Quercus rubra L.)插穗经400 mg·L−1 ABT1浸泡6 h后,生根率从0提高到16.7%[5];苏玛栎(Quercus shumardii)插穗在0.5 mg·L−1的IBA溶液中浸泡1 h,生根率可达24.2%[6]。
除植物生长调节剂,其它外源物质近些年被证明在促进插穗生根中发挥重要作用,但对栎树扦插效果及机制不清楚。发根农杆菌可诱导毛状根形成,利用该特性可促进苹果、大叶金叶椴、亚美马褂木等多种植物插穗生根[7]。亚美马褂木(Liriodendron sino-americanum)插穗经A4发根农杆菌菌液(OD600 = 0.5)处理后,生根率可提高43.4%。糠锻(Tilia mandschurica Rupr.er Maxim.)插穗经30 148发根农杆菌(OD600 = 1.0)结合IBA浸泡处理,生根率可达88.9%[8]。
丙环唑(PCZ)是油菜素甾醇合成抑制剂,参与植物激素信号调控。有研究表明,PCZ参与毛竹根基因表达调控,从而影响细胞壁、过氧化氢代谢分解和生长素相关基因表达[9]。基于烟草和棉花幼苗相关研究发现,适宜浓度PCZ可促进根径生长[10]和侧根数增多,并提高生根过程中的相关酶活性[11]。然而,PCZ是否能够促进植物插穗生根未知。
蒙古栎为扦插极难生根树种,目前尚未有成熟扦插技术报道,插穗生根机理不明确。探明植物扦插生根调控机理是提高植物插穗生根率的关键。在扦插生根过程中,营养物质、内源激素和酶的动态变化发挥重要调控作用[12]。本研究以蒙古栎当年生健壮嫩枝为扦插材料,使用不同浓度ABT1、IBA-K、K599发根农杆菌、PCZ及其组合处理,通过比较插穗的生根率、愈伤率、不定根数、根长等生长指标,探究蒙古栎扦插最适外源物质及浓度,揭示蒙古栎插穗难生根难机理,为蒙古栎规模化扦插育苗提供理论与技术指导。
-
试验材料采自辽宁省沈阳市高坎镇沈阳农业大学实验基地。插穗选取当年生长势良好、整齐一致、无病虫害嫩枝。插穗修剪成长10~12 cm,保留2片平切口叶。扦插基质选用蛭石和珍珠岩(1:1)。插床使用塑料大棚覆盖,外加70%透光率遮阳网。棚内相对湿度在扦插前期控制在70%~90%,生根后适当减小,温度控制在20~30 ℃。
K599发根农杆菌培养:用接种环蘸取少量甘油菌,在含50 μg·mL−1链霉素的TY平板上连续划动,重复操作2~3次。平板于28 ℃倒置培养2~3 d。挑取单菌落至1.5 mL含有链霉素抗性的LB液体培养基中,28 ℃,200 r·min−1摇菌12~24 h。取1 mL菌液加入到50 mL含有50 μg·mL−1链霉素抗性的LB液体培养基中,28 ℃,200 r·min−1摇床震荡培养5~6 h(OD600约为0.4)、7~8 h(OD600约为0.8)、9 h(OD600约为1.2)。
-
使用不同浓度IBA-K(A1:1 500 mg·L−1、A2:3 000 mg·L−1、A3:4 000 mg·L−1)、ABT1(B1:1 500 mg·L−1、B2:3 000 mg·L−1、B3:4 000 mg·L−1)、K599发根农杆菌(C1:OD600 = 0.4、C2:OD600 = 0.8、C3:OD600 = 1.2)、PCZ(D1:10 μmol·L−1、D2:50 μmol·L−1)处理插穗,以清水(CK1)和LB液体培养基(CK2)分别为对照。IBA-K、ABT1和清水处理采用速蘸法、K599菌液和LB液体培养基处理采用浸泡法(30 min)、PCZ处理也采用浸泡法(2 h)。每处理包括30根插穗,各处理3次重复。
-
以试验1.2.1结果中植物生长调节剂(IBA-K或ABT1)、发根农杆菌K599及PCZ各外源物质的最佳浓度进行组合处理,其中植物生长调节剂(IBA-K、ABT1)对蒙古栎插穗生根率影响没有显著差异(表2)。由此使用IBA-K(4 000 mg·L−1)、发根农杆菌K599(OD600 = 0.8)、PCZ(50 μmol·L−1)组合处理插穗。组合应用时,外源物质按表1顺序依次处理插穗。插穗在K599菌液与PCZ中采用浸泡法,分别浸泡30 min和2 h,IBA-K中采用速蘸法。每处理包括30根插穗,各处理3次重复。
组合处理
Combination treatment组合处理中外源物质及浓度
Exogenous substances and concentrations in combination treatmentE1 K599(OD600 = 0.8) + IBA-K(4 000 mg·L−1) E2 PCZ(50 μmol·L−1) + K599(OD600 = 0.8) E3 PCZ(50 μmol·L−1) + K599(OD600 = 0.8) + IBA-K(4 000 mg·L−1) E4 PCZ(50 μmol·L−1) + IBA-K(4 000 mg·L−1) E5 PCZ(50 μmol·L−1) + IBA-K(4 000 mg·L−1) + K599(OD600 = 0.8) 注:各组合处理按表中书写顺序依次处理插穗。例如:E1(插穗先在浓度为0.8的发根农杆菌 K599中浸泡30 min,接着在4 000 mg·L−1 IBA-K中速蘸)
Notes: Each combination processing according to the table in the order of writing processing cuttings. For example: E1 (the cuttings were soaked for 30 min in Agrobacterium rhizogenes K599 at a concentration of 0.8, followed by dipping at a medium speed of 4 000 mg·L−1 IBA-K)Table 1. - Combined application of different exogenous substances
处理
Treatment生根率
Rooting rate/%愈伤率
Callus rate/%不定根数
Root number平均根长
Average root/cm根系效果指数
Root indexA1 3.33 ± 0 dD 16.75 ± 1.95 cBC 2.33 ± 0.33 abAB 8.15 ± 1.35 aA 0.66 ± 0.21 cCD A2 0 dD 7.79 ± 1.12 deCD 0 cC 0 cB 0 dD A3 0 dD 0 eD 0 cC 0 cB 0 dD B1 0 dD 4.45 ± 1.11 eD 0 cC 0 cB 0 dD B2 1.11 ± 1.11 dD 14.50 ± 1.12 cdBC 0.33 ± 0.33 cC 1.90 ± 1.9 bcB 0.06 ± 0.06 dD B3 2.22 ± 1.11 dD 16.75 ± 1.95 cBC 1.33 ± 0.88 bcBC 5.28 ± 2.76 abAB 0.32 ± 0.19 cdD C1 14.50 ± 2.24 bB 36.39 ± 3.14 bA 1.80 ± 0.12 bABC 5.24 ± 0.18 abAB 1.35 ± 0.19 bB C2 24.71 ± 2.29 aA 37.56 ± 2.07 bA 3.07 ± 0.13 aA 6.08 ± 0.05 abAB 4.57 ± 0.23 aA C3 7.79 ± 1.12 cC 22.43 ± 3.01 cB 1.23 ± 0.23 bcBC 4.73 ± 0.23 abAB 0.47 ± 0.15 cdD D1 1.11 ± 1.11 dD 20.14 ± 1.96 cB 0.33 ± 0.33 cC 0.27 ± 0.27 cB 0.01 ± 0.01 dD D2 12.25 ± 1.12 bB 43.62 ± 2.47 aA 1.72 ± 0.03 bABC 4.91 ± 0.10 abAB 1.04 ± 0.09 bBC CK1 0 dD 7.79 ± 2.95 deCD 0 cC 0 cB 0 dD CK2 0 dD 1.11 ± 1.11 eD 0 cC 0 cB 0 dD 注:数据为平均值 ± 标准差,同一列不同大写字母表示不同处理间差异极显著(p < 0.01),不同小写字母表示不同处理间差异显著(p < 0.05)。下同
Notes: The data were showed by mean ± SD. Different capital letters in the same column indicate highly significant differences (p < 0.01), different capital letters indicate significant differences (p < 0.05). The same belowTable 2. Effects of different exogenous substances on the rooting of Quercus mongolica cuttings
-
试验使用50 μmol·L−1 PCZ浸泡2 h的插穗为处理组、清水浸泡2 h的为对照组。每处理300个插穗,3次重复。基于蒙古栎插穗生根特点,扦插过程中每10 d进行一次取样,共取7次。每次取样时将穗条附着基质清洗干净,擦干后快速取下基部2~3 cm韧皮部,剪碎混匀后液氮速冻,并于−80 ℃保存。
生根过程各时期韧皮部可溶性糖含量、淀粉含量、过氧化物酶(POD)和吲哚乙酸氧化酶(IAAO)活性测定参照张志良[13]等人的方法。蛋白质含量测定参照李合生[14]的方法。多酚氧化酶(PPO)活性测定参照李忠光等[15]的方法。吲哚乙酸(IAA)、脱落酸(ABA)、赤霉素(GA3)和玉米素核苷(ZR)含量,均采用酶联免疫法(ELISA)测定,酶联免疫法(ELISA)试剂盒购自武汉纯度生物科技有限公司。每测定包括3次重复。
使用SPSS 26.0 进行单因素方差和多重比较分析,分析前对百分率数值进行反正弦转换(sin−1)。数据可视化使用Origin 2021和R进行。
-
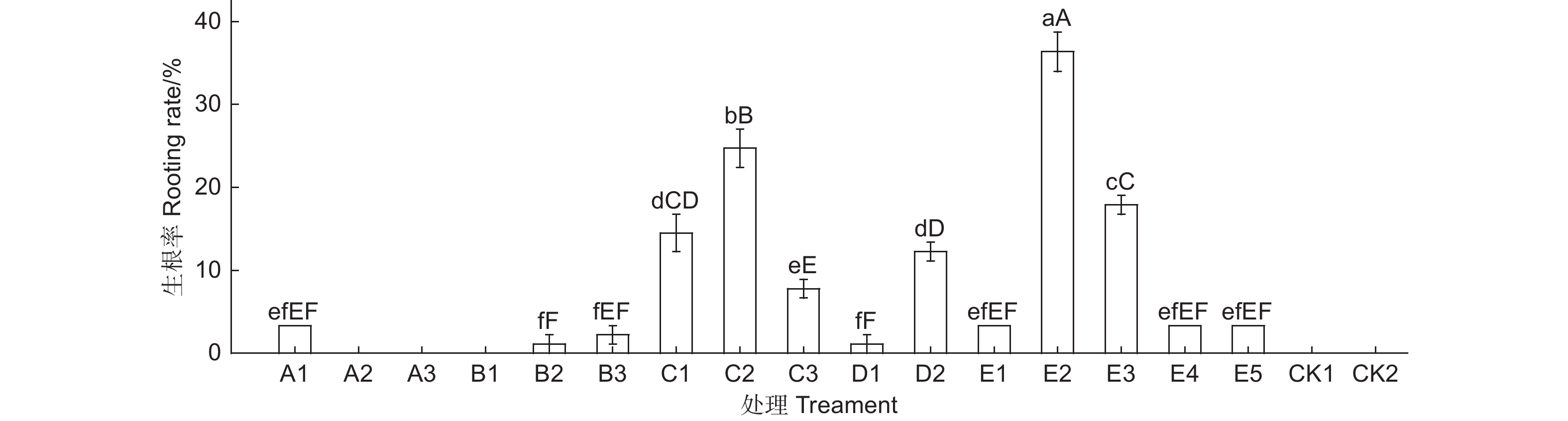
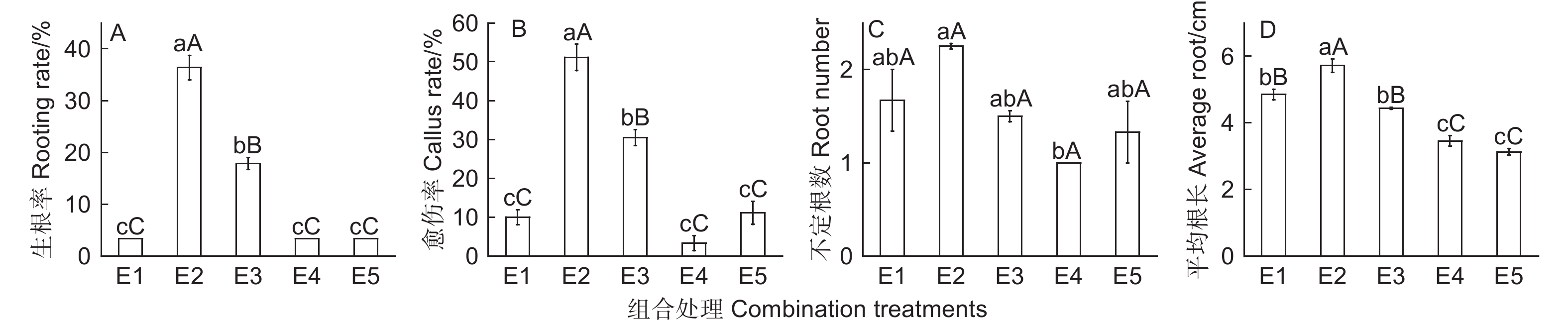
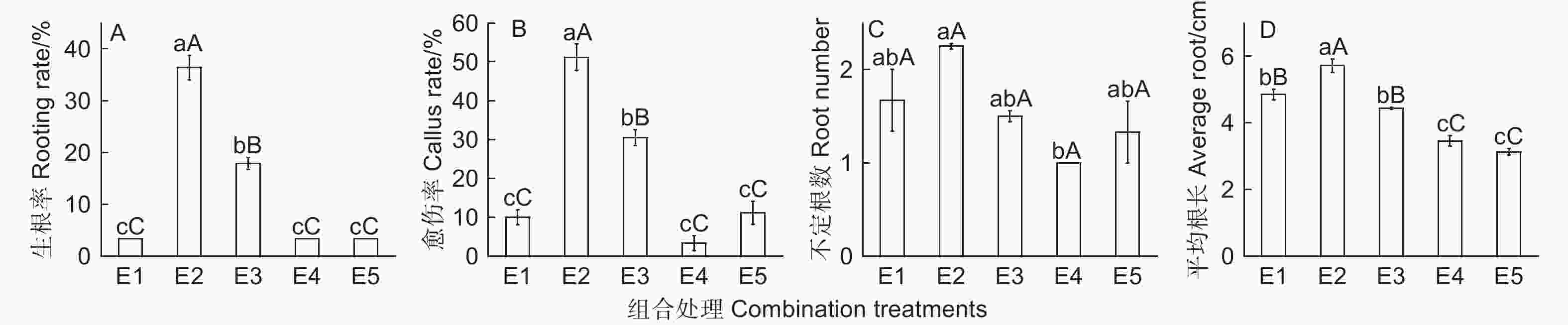
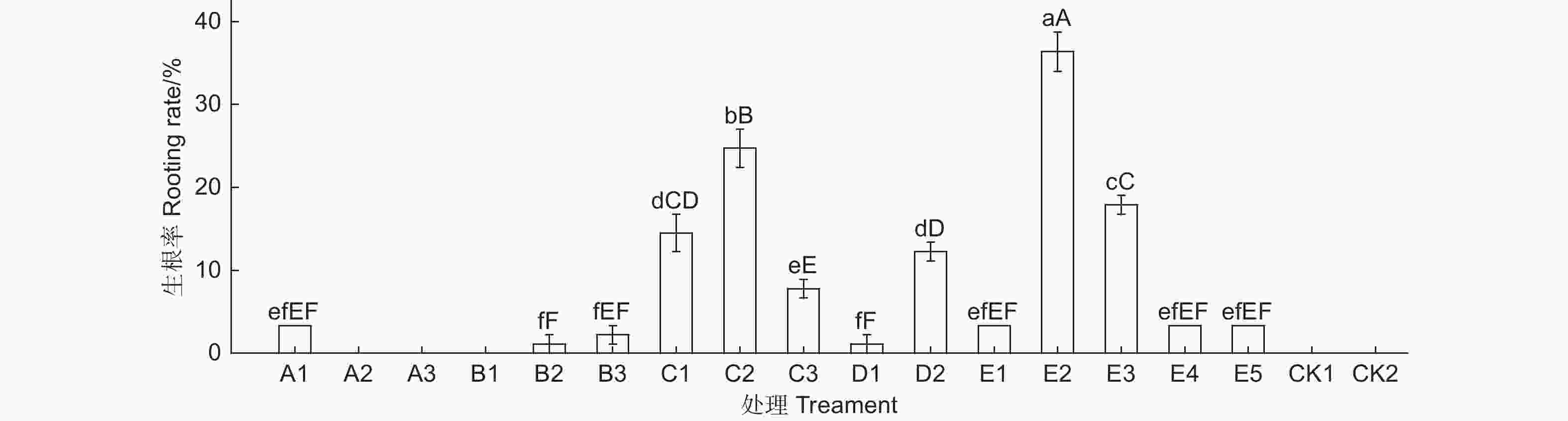
不同外源物质及浓度对蒙古栎扦插生根率、愈伤率等具有极显著影响(表2)。其中,植物生长调节剂IBA-K和ABT1处理后对插穗生根率没有显著促进作用。对于K599发根农杆菌,随菌液浓度升高,插穗生根率、不定根数先升高后降低。菌液浓度(OD600)为0.8(C2)时插穗生根率、根系效果指数等最高,生根率达到24.71%,根系效果指数为4.57。此外,50 μmol·L−1 PCZ处理(D2)也能显著促进插穗生根,生根率达12.25%,愈伤率和不定根数等均高于10 μmol·L−1处理(D1)。
-
不同外源物质组合应用对蒙古栎插穗生根、愈伤形成和根长具有极显著影响(图1)。不同组合处理,插穗生根率和愈伤率变化较一致(图1A、B)。各组合处理间插穗不定根数变化不显著(图1C),但组合应用中含有IBA-K时(E1、E3~E5),不定根数降低。此外,PCZ与IBA-K组合处理后(E4、E5),插穗平均根长均较低(图1D)。不同外源物质组合处理间,50 μmol·L−1 PCZ 结合K599发根农杆菌(OD600 = 0.8)处理(E2)能明显促进插穗根系生长(图2A、B),生根率可达36.67%,并显著高于两种外源物质单独处理时的生根率(图3)。
-
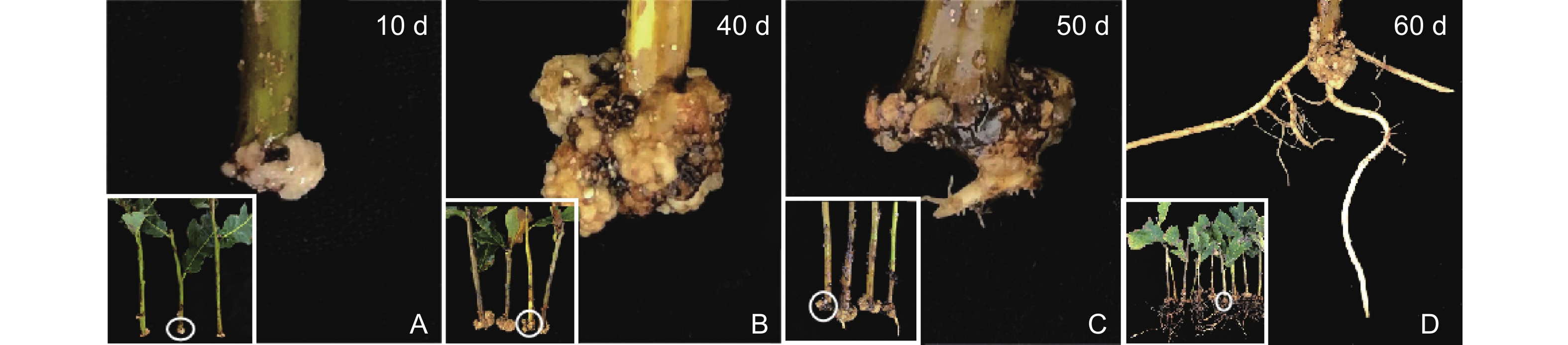
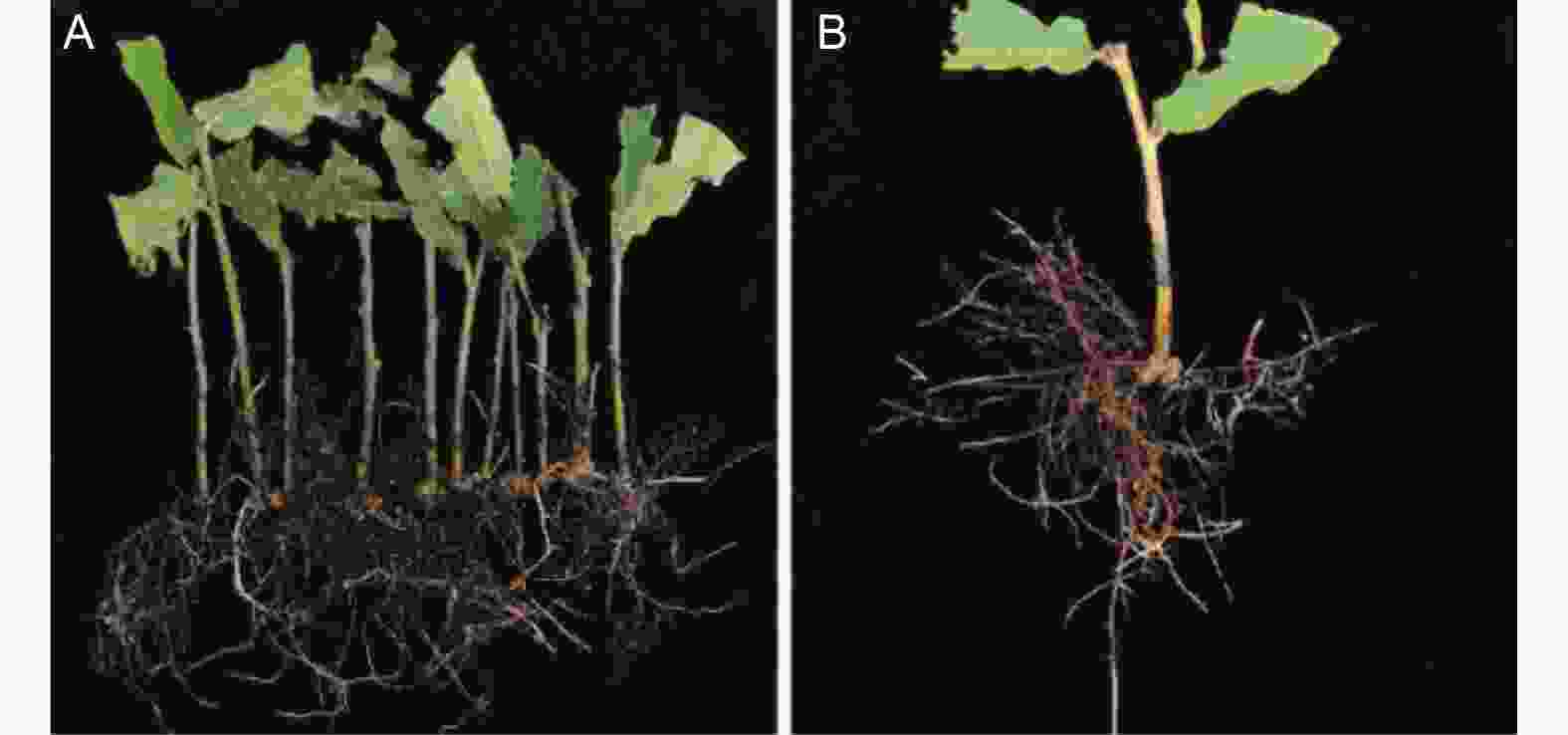
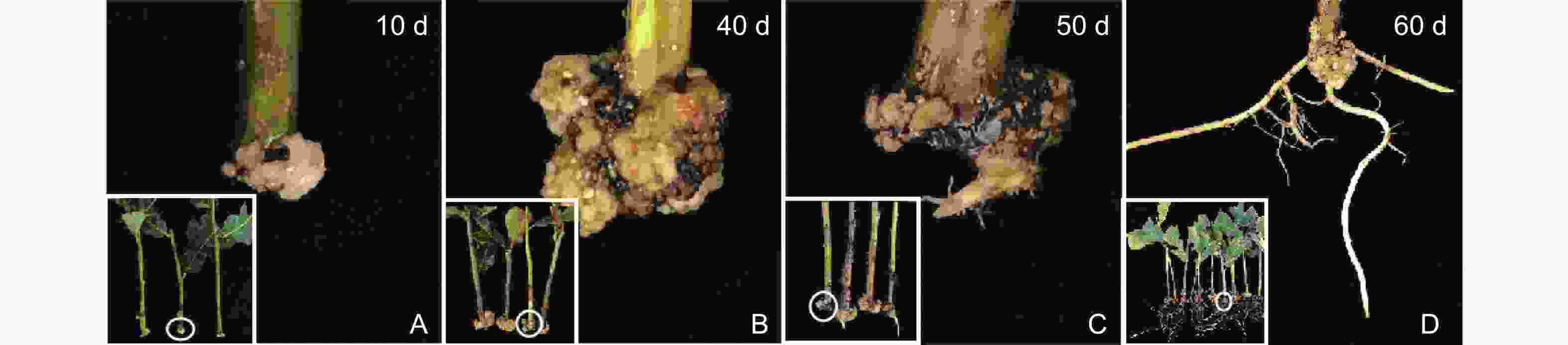
蒙古栎嫩枝扦插生根约需50 d(图4)。0~40 d,插穗基部形成愈伤组织(图4A),且愈伤组织不断生长(图4B);50 d,不定根形成(图4C);60 d,不定根伸长生长(图4D)。
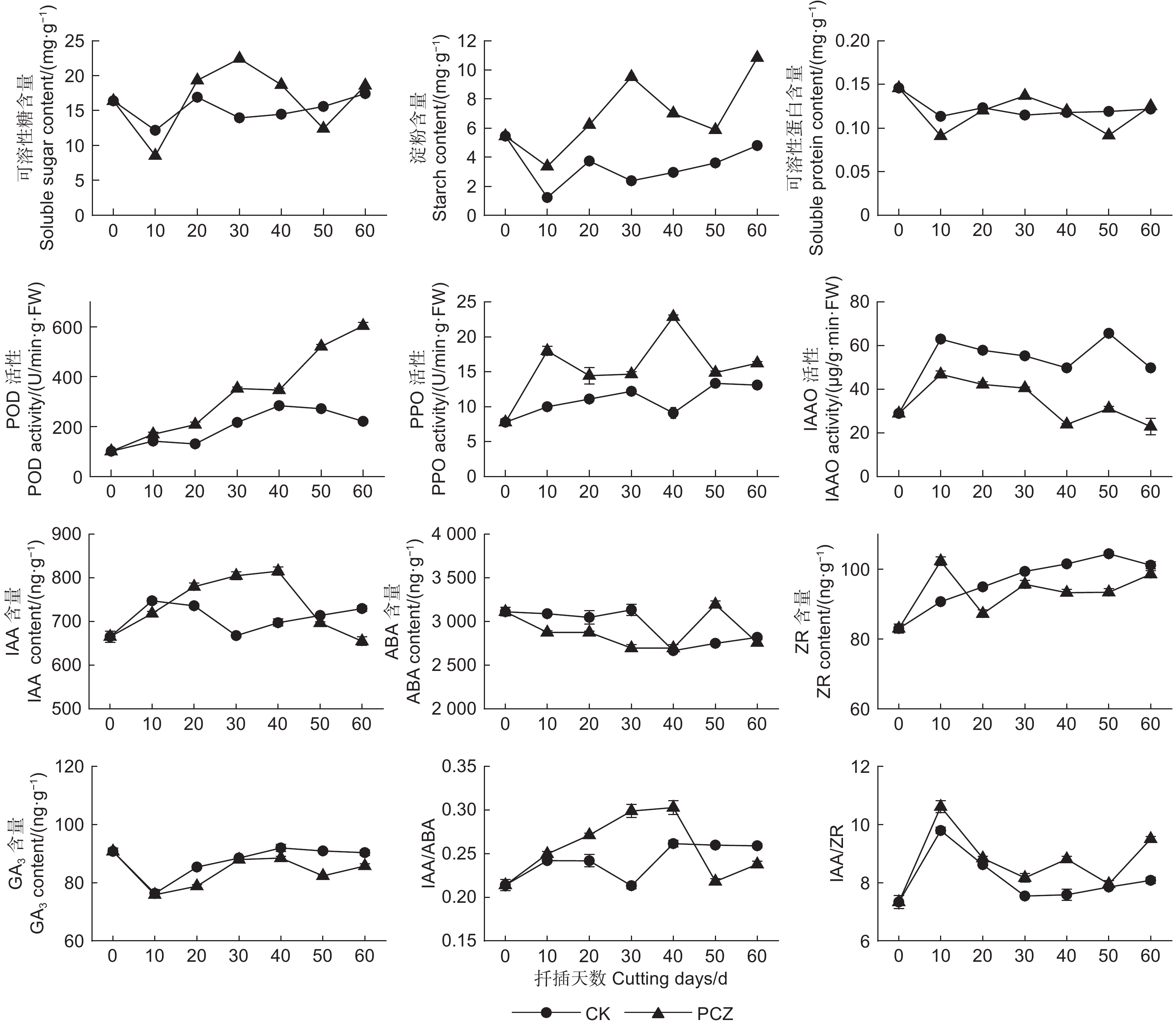
PCZ(50 μmol·L−1)处理能显著提高不定根诱导时期插穗营养物质积累,尤其淀粉(图5)。相较对照,PCZ处理后插穗各营养物质含量变化呈波动趋势。初期(0~10 d),插穗可溶性糖和蛋白等分解加快,在10~40 d内,快速上升后逐渐下降,直至不定根出现(40~50 d),不定根出现可能与营养物质供给有关。扦插后期,PCZ处理后营养物质快速积累,此原因可能与叶片光合作用合成的营养物质多于消耗的营养物质有关。此外,在生根过程中,PCZ处理后各时期插穗淀粉含量均显著高于对照组。
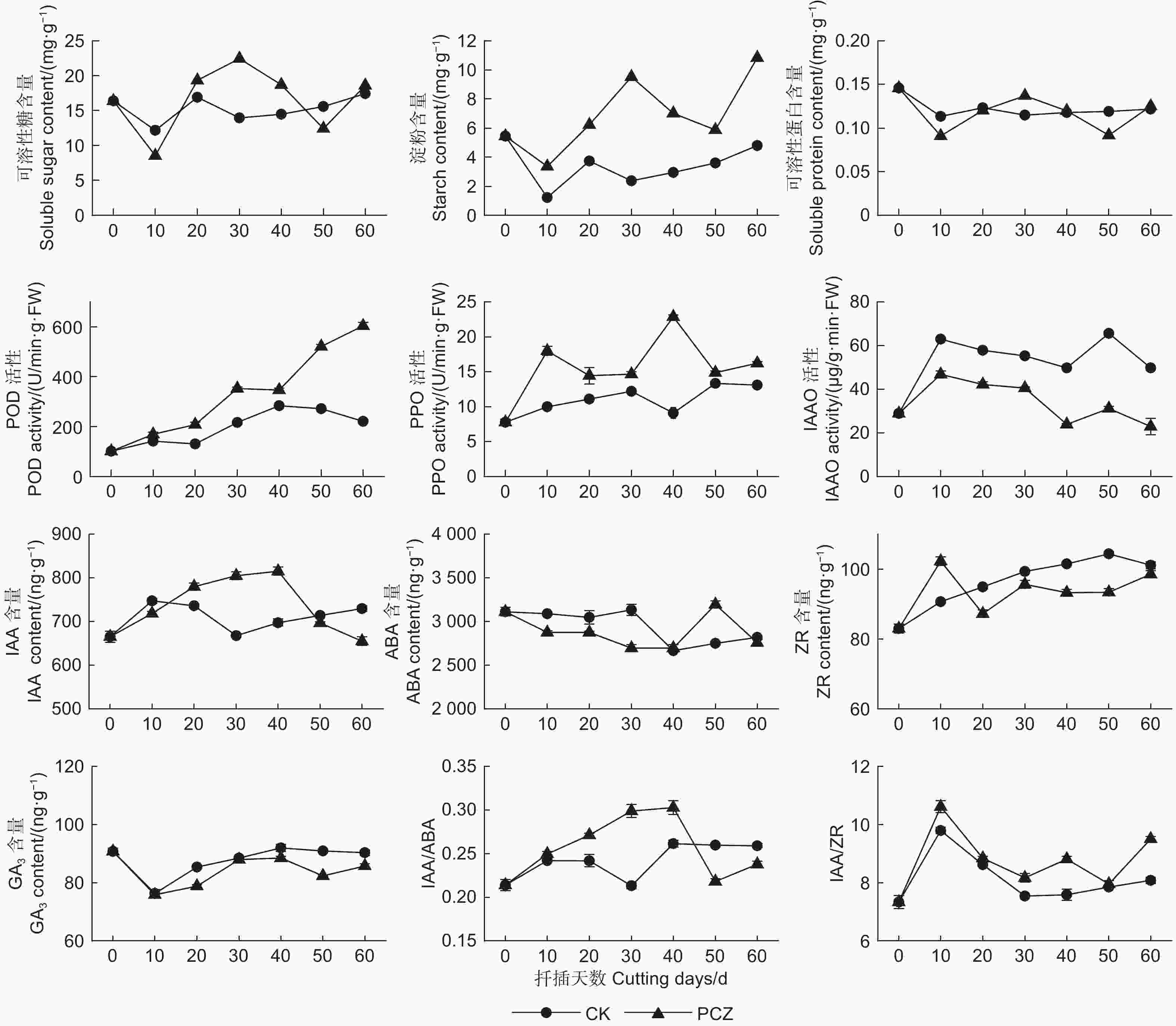
Figure 5. - Changes in endogenous substances during rooting of Quercus mongolica cuttings treated with PCZ
PCZ处理促进POD、PPO活性提高,抑制IAAO活性(图5)。PCZ处理后插穗POD和PPO活性始终高于对照。扦插后期(40 d后),PCZ处理的插穗POD活性急剧增加。相比对照,PCZ处理后插穗PPO活性变化波动剧烈。处理组和对照组的IAAO活性变化趋势相似,PCZ处理后插穗的IAAO活性始终低于对照。初期(0~10 d),IAAO活性升高,随后在不定根诱导时期(10~40 d),IAAO活性总体呈下降趋势,促进插穗不定根形成。
PCZ处理后插穗IAA含量上升,ABA、GA3和ZR含量降低,IAA/ABA或IAA/ZR比值增大(图5)。插穗生根前(0~40 d),PCZ处理后插穗IAA含量持续上升至峰值,不定根形成和生长时期(40~60 d),IAA含量迅速下降。PCZ和对照处理后插穗ABA总体含量呈现下降趋势,0~40 d内对照组的ABA含量始终高于处理组,而后处理组的ABA含量迅速上升至最大值又下降。对照组和处理组的ZR含量变化规律相似,处理组ZR总体含量低于对照组。扦插初期(0~10 d),ZR含量急剧下降,而后插穗自身开始合成ZR,使其含量上升。0~10 d,处理组的GA3含量迅速上升至峰值,促进愈伤组织形成,而后急剧下降,且含量始终低于对照组含量。PCZ处理后插穗IAA/ABA值呈升高-降低-升高趋势,0~40 d,比值逐渐升高至峰值,促进插穗根原基形成。PCZ处理后插穗IAA/ZR值始终高于对照组,并在愈伤组织开始形成(0~10 d)和不定根伸长生长时期(50~60 d)快速升高。
-
发根农杆菌Ri质粒上T-DNA片段插入宿主基因组后能诱导植物生成毛状根[16]。此外,发根农杆菌能够提高插条生根期IAA/ABA比值和插穗基部可溶性糖及全氮含量,促进扦插生根[7]。然而,不同菌株及浓度诱导植物愈伤组织和毛状根的效果不同。在研究木豆高效转基因系统时发现,菌株K599相较于其它菌株诱导愈伤和毛状根的作用最显著,并在多种草本、灌木和木本植物上成功应用。此外,研究还发现不同菌液浓度诱导效果不同[17]。适宜的菌株及浓度对提高植物生根率尤为关键。本研究发现,使用OD600值为0.8的K599发根农杆菌,对蒙古栎扦插生根促进效果最显著,生根率和愈伤率分别为24.71%和37.56%。
PCZ是一类油菜素内酯(BR)合成抑制剂。研究表明,低浓度BR可以加速生长素极性运输,诱导侧根发生[18],调控细胞扩增和伸长从而促进根长[19]。PCZ能够降低植物内源性BR含量,从而调控根生长。50 μmol·L−1 PCZ处理蒙古栎插穗,愈伤率达43.62%,但生根率仅为12.25%,其原因可能是:PCZ促进基部愈伤组织分裂能力,使插穗长时期停留在愈伤组织生长过程,插穗出现假活现象。PCZ结合K599发根农杆菌处理后,插穗不定根显著增加,生根率达36.67%。
插穗基部作为一个有效的养分库,具有充足的营养物质才能形成根原基并快速生根[20]。PCZ通过提高插穗内营养物质(可溶性糖、淀粉和可溶性蛋白)代谢,在根诱导关键期时增加营养物质积累,促进插穗生根。在秤锤树(Sinojackia xylocarpa Hu)扦插研究中发现,生根过程需要消耗插穗内部大量糖和蛋白[21],这与本研究结果相似。郝海坤等在红锥(Castanopsis hystrix Hook. f. & Thomson ex A. DC.)嫩枝扦插试验中发现生根区高的可溶性蛋白积累促进生根[22]。蒙古栎插穗扦插生根率低可能是因为营养物质(可溶性糖、蛋白)含量不能满足不定根形成和伸长。
PCZ处理促进POD、PPO活性提高,抑制IAAO活性。POD能够氧化内源IAA并促进酚类物质合成木质素,有利于根原基伸长和根木质化,被认为是一种生根潜力指标,如POD活性较高的胡杨(Populus euphratica Oliv.)插穗具有较强的生根能力[23]。本研究中,PCZ处理后,插穗不定根形成时POD活性显著上升(图5)。植物生根能力与PPO活性呈正相关,这与PPO能催化酚类物质与IAA结合,形成一种生根辅助因子“IAA-酚酸复合物”,从而诱导根原基的生长发育[24]。本研究发现PCZ处理后的插穗在扦插初期和不定根诱导关键时期PPO活性急剧上升,促进愈伤组织和根原基形成。楸树(Catalpa bungei C. A. Mey.)[25]和牡丹‘凤丹白’(Paeonia ostii ‘Feng Dan White’)[26]PPO活性在不定根发生脱分化期和诱导期逐渐升高并达到峰值,继而促进根形成和发育,这同本研究结果相似。同蒙古栎,欧榛(Corylus avellana L.)[27]和含笑‘香妃’(Micheliafigo ‘Xiangfei’ )[28]在扦插生根进程中均发现IAAO含量高不利于扦插生根,这可能与IAAO可抑制IAA含量,低浓度IAA不利于生根。
PCZ处理显著促进插穗内IAA含量积累,抑制ABA、GA3和ZR合成,并在一定程度上提高IAA/ABA或IAA/ZR比值。IAA参与调节植物根原基诱导、愈伤组织形成与不定根发育生长每个阶段。尚文倩[26]和ALMEIDA[29]等通过免疫组织定位法对牡丹‘凤丹白’不定根发生过程中的内源IAA进行定位,发现根原基是IAA分布的中心,在诱导根原基时开始积累,在根原基开始发育时达到最大值,因此在根原基积累足够量的IAA是不定根形成的重要基础。这与本试验中发现IAA含量在不定根形成前达到峰值,利于生根的结论一致。ABA对不定根发生具有抑制作用,而低浓度细胞分裂素促进不定根发生。内源ABA含量高的毛白杨(Populus tomentosa Carrière)插穗生根能力低[30],低浓度ZR有利于裸花紫株(Callicarpa nudiflora Hook. et Arn.)插穗不定根生长和伸长[31],此结论与本研究结果较一致。然而,有研究发现在蓝莓(Vaccinium corymbosum)[32]扦插时,较高浓度细胞分裂素利于细胞分裂分化,促进根原基分化和根形成。目前,关于赤霉素类(GAs)对木本植物插穗不定根发生的作用仍存在较大争议。大量研究表明内源GA抑制不定根发生,这可能与GA在扦插起始期阻碍插穗基部细胞分裂有关[33]。内源GA3含量与山杏(Armeniaca sibirica L.)插穗的生根率呈负相关[34]。植物的生理效应往往不是由某种激素的绝对含量决定,而是各种激素相互协同作用。IAA/ABA或IAA/ZR比值增大,会促进愈伤组织形成和根原基发育[35]。王清民等[36]和董胜君等[34]分别在核桃(Juglans regia L.)和山杏的生根研究中发现:IAA/ABA比值在根诱导期达到峰值,并推测高IAA/ABA有利于根原基形成。
-
开展外源物质对蒙古栎扦插生根及生根机理研究尤为重要。采用不同外源物质及组合应用处理蒙古栎插穗发现,不同外源物质及组合应用对蒙古栎扦插生根具有显著影响,其中单独使用K599发根农杆菌(OD600 = 0.8)浸泡30 min后插穗生根率为24.71%,与50 μmol·L−1 PCZ组合处理对蒙古栎扦插苗生根率、愈伤率等促进作用最显著,生根率可达36.67%。PCZ处理后蒙古栎插穗内源性物质发生显著变化,并发现提高插穗内可溶性糖、蛋白、IAA含量和抗氧化酶(PPO、POD)活性有助于蒙古栎扦插生根。本研究主要探究促进蒙古栎扦插生根的外源物质种类及浓度,下一步可以结合防褐化和黄化处理等技术进行研究,有助于完善蒙古栎规模化扦插育苗体系。
Effects of Different Exogenous Substances on Rooting, Basal Physiology and Biochemistry of Quercus mongolica Cuttings
- Received Date: 2023-09-12
- Accepted Date: 2013-03-18
- Available Online: 2024-04-01
Abstract:





 DownLoad:
DownLoad: