-
油松(Pinus tabulaeformis Carriere.)是我国华北地区典型的植被类型,适应性强,具有耐低温、干旱和瘠薄等特点[1]。由于经营管理不到位,人工营造的油松林存在生产力低下、生物多样性下降、稳定性差等问题。随着退化生态系统修复和恢复工程的实施,大面积的油松人工林质量得到改善,但对其恢复阶段和效果仍缺乏有效的评估。
土壤微生物种类在土壤生态系统养分循环和能量流动过程中起纽带作用[2-3],推动植物生长发育和群落演替[4]。对森林采取不同经营措施能够改变林下小气候[5],并通过影响林下植物群落,改变凋落物和根系分泌物的组成[6],对土壤微生物群落造成影响。土壤微生物多样性是增强微生物功能和生态系统稳定性的重要因素[5],对环境人为扰动非常敏感[7],研究表明不同土地利用方式及森林管理措施在一定程度上干扰了土壤环境[8],导致土壤微生物群落发生改变[9],采伐活动会对土壤微生物群落的结构、多样性和丰度造成不同程度的影响[10],有利于土壤真菌群落进行养分循环[11]。土壤微生物与植被形成相互作用的反馈体系,既受到地上植被类型的影响,又通过其自身性质的改变反作用于植被[12]。土壤微生物可以反映生态系统土壤理化性质和功能多样性的恢复程度,是反映植被恢复进展的重要参考指标[13],微生物群落的多样性水平与生态系统的结构、功能密不可分,其活性变化影响生态系统地球化学过程[10]。
目标树经营是以单株林木为对象,通过伐除干扰木为目标树提供更多生长空间[14],降低邻木冠层竞争,从而提高单株木质量的营林技术[15]。前人相关的研究很多,主要关注目标树生长变化[16-17]及目标树经营对林分生长与结构的影响机制[15]。目标树经营对油松人工林养分动态和土壤微生物群落的影响机制需进一步研究。本研究以山西省中条山结构调整前后的油松人工林为研究对象,其中一块进行了多次的目标树经营,每次经营力度约为25%,另一块则未进行相关的经营活动。探讨结构调整后油松人工林林下土壤养分及微生物群落结构的响应动态,梳理油松人工林土壤生态系统对结构调整的应对机制,有助于提高对人工林土壤生态恢复的认识,也为确定油松人工林的科学经营成效和提高油松人工林保护管理质量提供科学依据。
-
中条山位于山西省西南部,地处34°38′~35°37′N,110°15′~112°37′,属太行山向南延伸的余脉,山体走向为北东-西南。该区属温暖带半湿润大陆性季风气候,年均温为10.3~14.3 ℃,1月均温为−8.5~4.6 ℃,七月均温为30.6~33.8 ℃,年均降水量为524.3~654.3 mm,多集中在7—9 月,无霜期190~229 d。油松人工林分布区土壤为淋溶褐土及山地褐土,土层较厚。主要森林植被类型有油松林、橿子栎(Quercus baronii Skan)林、侧柏(Platycladus orientalis Linn.)林、栓皮栎(Quercus variabilis Bl.)林、白桦(Betula platyphylla Suk.)林和辽东栎(Quercus wutaishanica Mary)林等。灌丛植被类型主要有三裂绣线菊(Spiraea trilobata L.)灌丛、酸枣(Ziziphus jujuba var. spinosa (Bunge) Hu ex H.F.Chow.)灌丛、连翘(Forsythia suspensa Thunb.)灌丛、黄栌(Cotinus coggygria Scop.)灌丛、荆条(Vitex negundo var. heterophylla (Franch.) Rehd.)灌丛等。草本植物群落主要蒿类(Artemisia spp.)草丛、白羊草(Bothriochloa ischaemum (L.) Keng)草丛、薹草(Carex spp.)草甸等。
-
2018年选取中条山油松人工林作为研究对象,选取两块林龄相近,坡向、坡度和海拔等地形因子、土壤类型基本相似的林地作为研究对象,一块样地自2000年以来只选择并标记目标树和干扰树,未进行间伐作业,该样地作为对照样地(CK)。另一块样地自2000年起每4 年1 次,进行了多次目标树经营,目标树经营密度为300 株∙hm−2,该样地为经营样地(TZ)。经营样地内选取生长力旺盛、状态良好、干形饱满通直、没有机械损伤和病虫害的林木作为目标树,干扰树为冠层影响目标树生长的林木。间伐强度设计为25%,在间伐强度控制下,从干扰树中随机选择采伐木,12月进行间伐作业。
2018年6—8月在两个样地各设置3个20 m × 20 m的样方,共计6个样方。对2个样地进行基本状况调查,包括:平均树高、平均胸径、林龄、林分密度等。并进行土壤样本的采集。
样地编号
Sample plot No林龄
Age/a海拔
Elevation/m坡向
Aspect坡度
Slope/(º)郁闭度
Canopy/%林分密度
Density/(株∙hm−2)平均胸径
Averageof DBH/cm平均树高
Average of height/mCK 39 1997 S 30 0.75 2475 12.9 7.7 TZ 46 1985 S 28 0.72 675 15.3 8.3 注:S代表南,CK代表未进行结构调整的对照样地,TZ代表已进行结构调整的样地
Notes: S represents the south, CK represents the control plot without structural adjustment, TZ represents the plot with structural adjustmentTable 1. Basic information of Pinus tabulaeformis sample plot
-
在每个样方内按照“S”形选取3个土壤采样点均匀混合采样,先去除土壤表面的凋落物,采集0~20 cm土壤样品。剔除根、石块等杂质混合土样,放入消毒无菌的自封袋,置于4 ℃冷藏箱保存并尽快带回实验室,过2 mm筛,一部分保存于−80 ℃冰箱中,用于土壤微生物多样性分析;另外一部分土壤样品自然风干,用于土壤理化性质分析。
有机质SOM含量采用重铬酸钾氧化-分光光度法测定;全氮TN含量采用凯氏定氮法测定(LY/T 1228-2015)[18];速效氮(AN)采用碱解扩散法测定;全磷(TP)和速效磷(Olsen-P)采用等离子发射光谱法(仪器名称 IRIS Intrepid Ⅱ XSP)测定,pH采用pH酸度计法(仪器名称HANNA pH 211酸度计)。
-
利用MP-Fast DNA Spin kit for soil 试剂盒(Omega Biotek,Norcross,GA,U.S.)进行土壤DNA提取,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量;细菌利用515F(GTGCCAGCMGCCGCGG) 和907R(CCGTCAATTCMTTTRAGTTT) 引物对V4-V5可变区进行PCR扩增,真菌利用ITS1(CTTGGTCATTTAGAGGAAGTAA)和ITS2(GCTGCGTTCTTCATCGATGC)引物进行PCR扩增,利用Miseq 2 × 250 bp测序(上海天昊生物科技有限公司)。
-
基于OTU计算Chao1丰度指数,覆盖度(Coverage)和Shannon多样性指数。在门水平上统计每个样品的群落组成,进行主成分分析(PCA)。利用冗余分析(RDA)研究土壤化学指标与微生物群落关系。利用SPSS18.0软件,通过单因素方差分析(One-way analysis)对各样地之间的显著性差异进行分析,采用Pearson相关系数对微生物丰度和土壤理化性质进行相关性分析。
-
对多次结构调整的油松人工林和CK样地的土壤理化性质进行测定,每个样地土壤理化性质以所有测定值的平均值表征。结果显示,与CK样地相比,多次结构调整后的油松人工林土壤化学性质差异显著(表2)。土壤有机质、全氮、碱解氮、Olsen-P、pH值均显著低于CK对照样地(p<0.05)。土壤C/N略高于对照样地,但差异不显著。由此可见,结构调整后油松人工林土壤养分较对照样地有所降低,但C/N值差异不大。
样地
Plots有机质
SOM/(g·kg−1)全氮
TN/(g·kg−1)全磷
TP/(g·kg−1)pH C/N 碱解氮
AN/(mg·kg−1)速效磷
Olsen-P/(mg·kg−1)CK 69.01 ± 4.00 a 3.35 ± 0.25 a 0.65 ± 0.13 a 7.15 ± 0.62 a 20.52 ± 0.45 a 285.93 ± 6.62 a 6.51 ± 0.35 a TZ 48.73 ± 7.05 b 2.26 ± 0.45 b 0.47 ± 0.15 a 6.47 ± 0.30 b 21.51 ± 1.65 a 180.38 ± 26.59 b 4.89 ± 0.18 b 注:表中数据为均值 ± 标准差(n=3),不同小写字母表示不同处理之间差异显著(p<0.05)
Notes: Different lowercase letters indicate significant differences between different treatments (p<0.05)Table 2. Physical and chemical properties of soil before and after structural adjustment
-
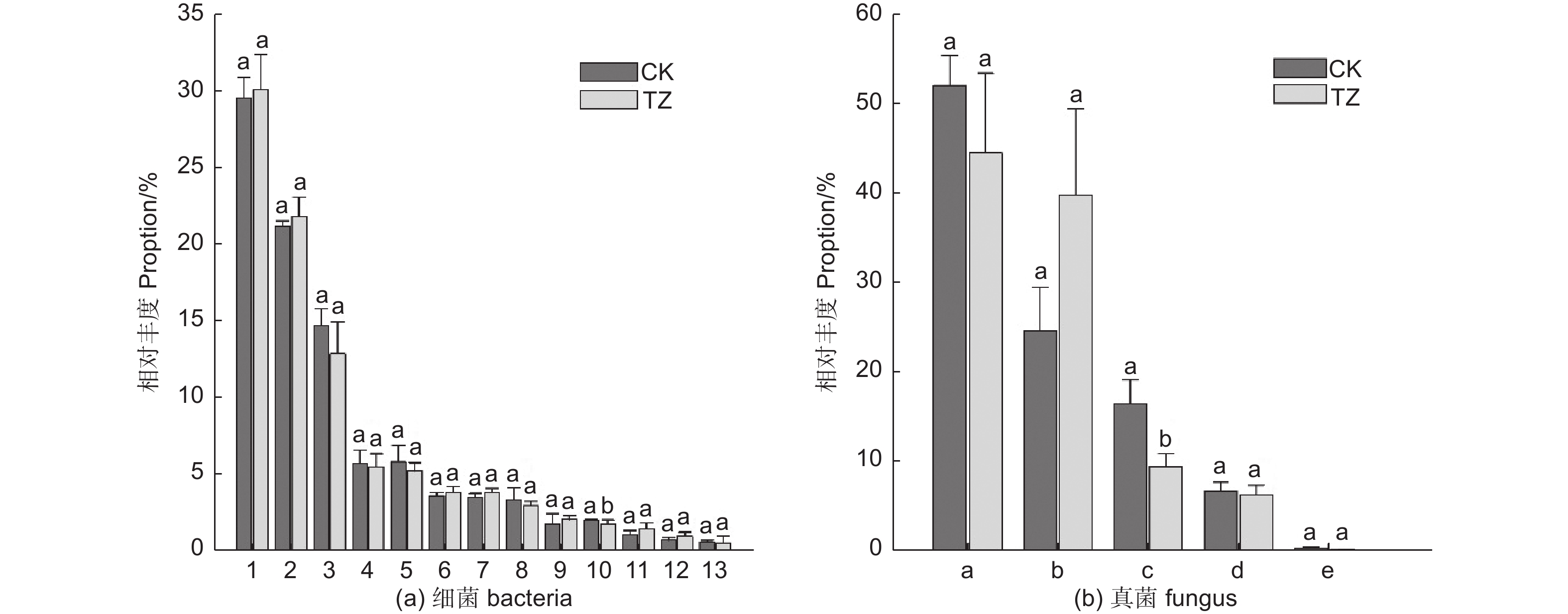
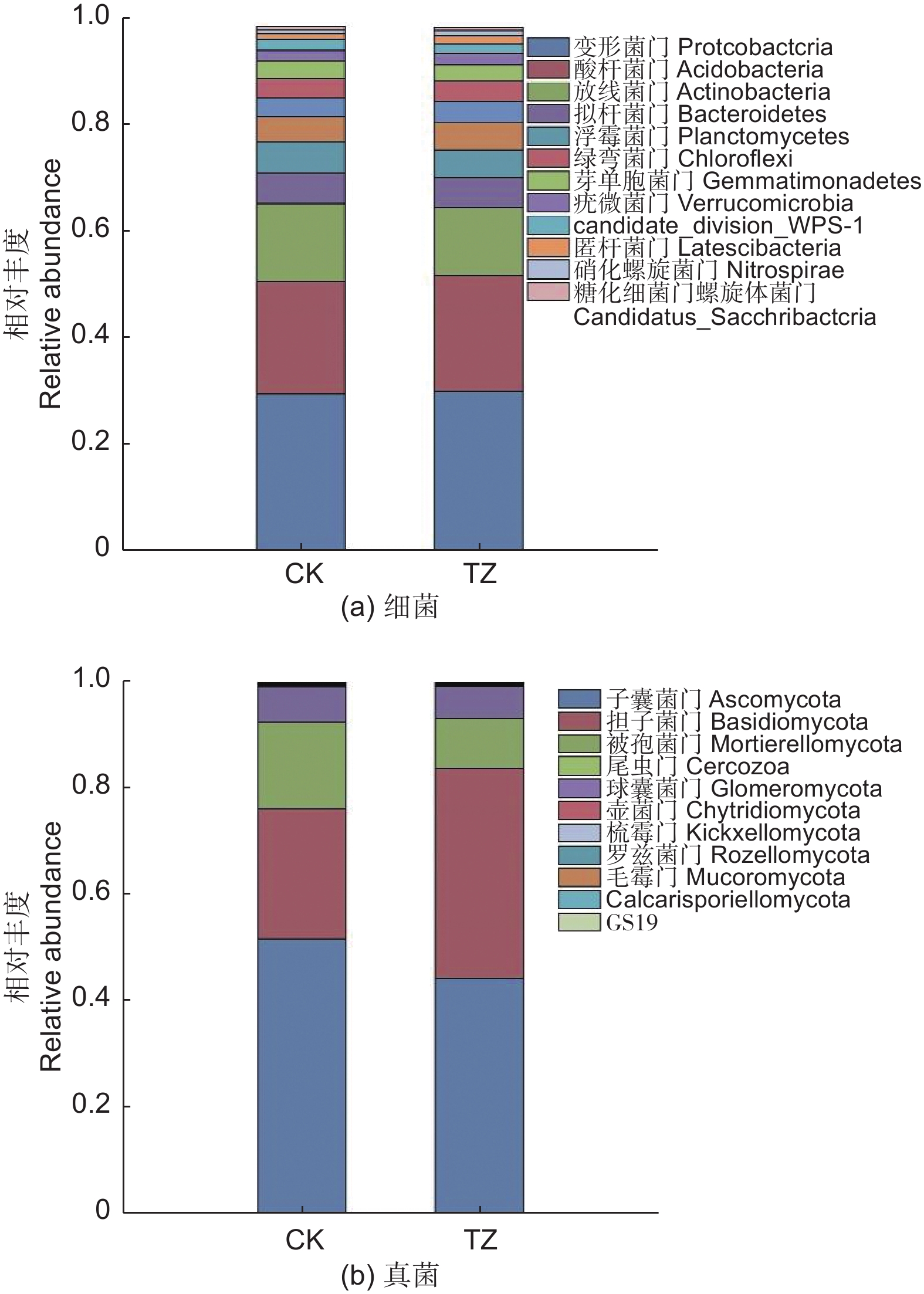
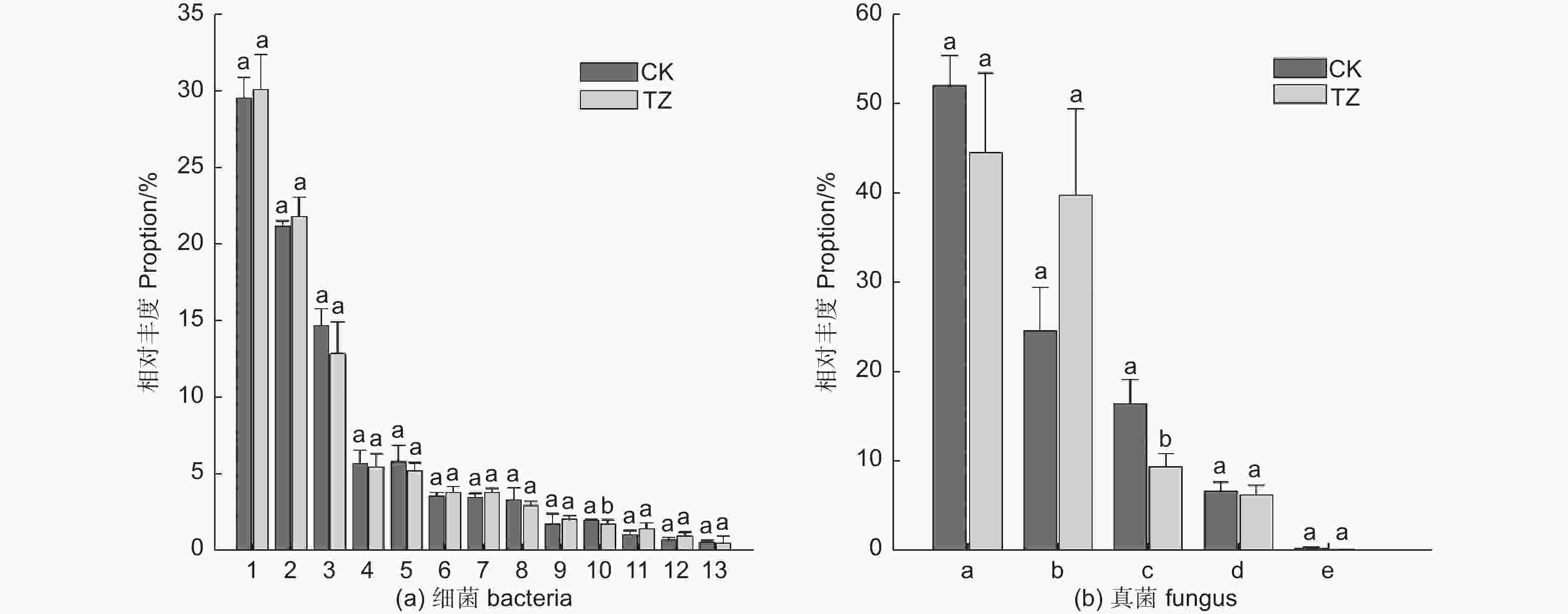
对未进行结构调整的油松人工林对照样地CK进行采样,共采集到细菌涉及35门63纲76目(图1a),相对丰度大于1%的主要细菌门类有:变形菌门(Proteobacteria,29.5%)、酸杆菌门(Acidobacteria,21.14%)、放线菌门(Actinobacteria,14.74%)、浮霉菌门(Planctomycetes,5.87%)、拟杆菌门(Bacteroidetes,5.77%)、绿弯菌门(Chloroflexi,3.55%)、芽单胞菌门(Gemmatimonadetes,3.42%),candidate_division_WPS-1,2.06%、疣微菌门(Verrucomicrobia,1.84%)、匿杆菌门(Latescibacteria,1.11%)、厚壁菌门(Firmicutes,1.60%)、糖化细菌门螺旋体菌门(Candidatus_Saccharibacteria,1.59%)、装甲菌门(Armatimonadetes,1.44%)。另外,还检测到一些,如:迷踪菌门(Elusimicrobia)、衣原体门(Chlamydiae)、小基因组菌总门(Microgenomates)、俭菌总门(Parcubacteria)、Ignavibacteriae、BRC1、Cyanobacteria、硝化螺旋菌门(Nitrospirae)、Hydrogenedentes等,相对丰度之和为2.7%。其中相对丰度超过7%的门有变形菌门、放线菌门和酸杆菌门。
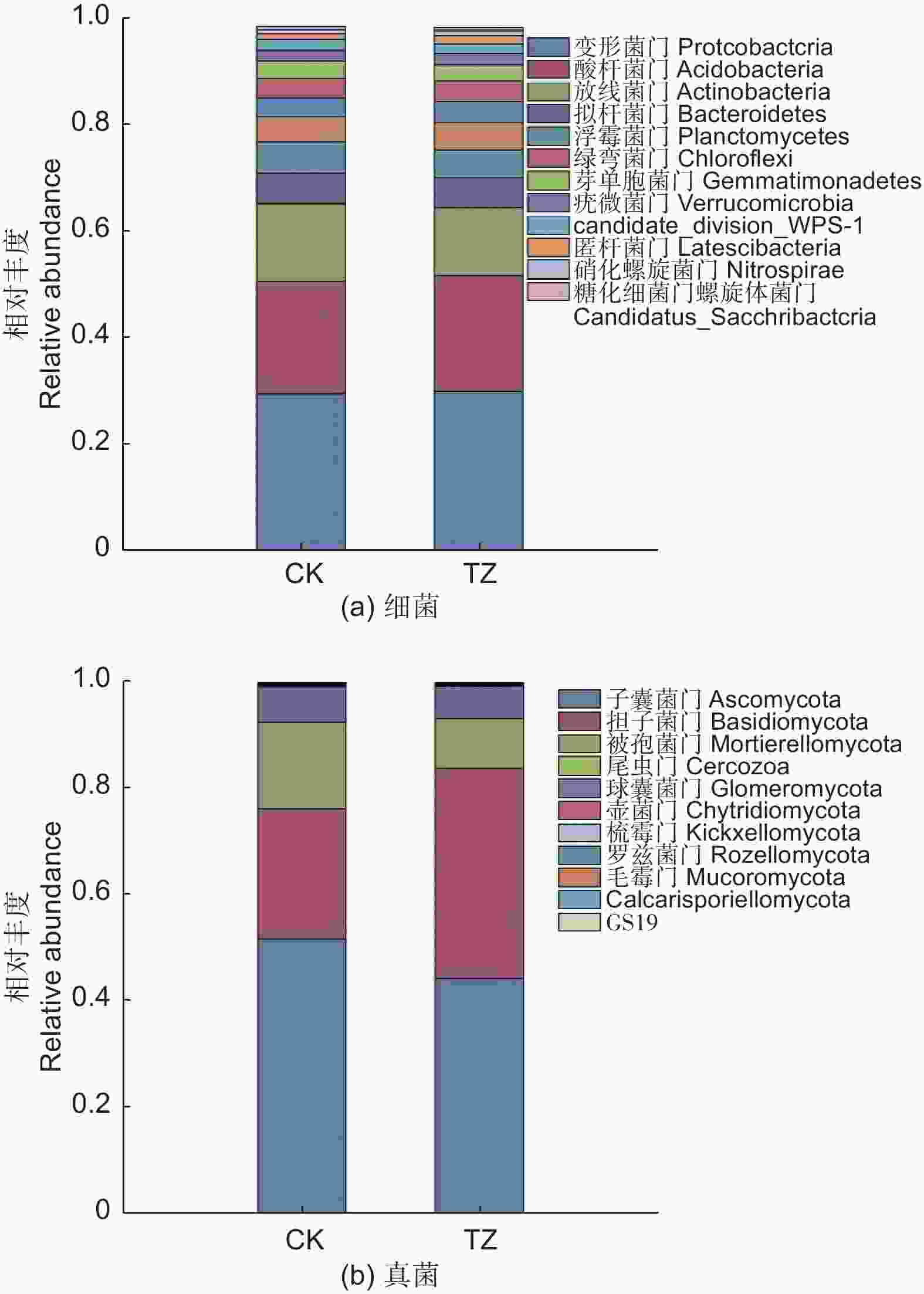
Figure 1. Histogram of species composition of soil bacterial species in Pinus tabulaeformis plantations after structural
结构调整后的油松林TZ样地中土壤微生物类群,经过数据质控和去除嵌合体,总共获得OTU17 262个,34门63纲78目,涉及主要的细菌门类为:变形菌门(30.03%)、酸杆菌门(21.8%)、放线菌门(12.88%)、拟杆菌门(5.5%)、浮霉菌门(5.27%)、绿弯菌门(3.88%)、芽单胞菌门(3.05%)、疣微菌门(2.12%)、(candidate_division_WPS-1,1.85%)、匿杆菌门(1.51%)、硝化螺旋菌门(1.02%)。另外,还检测到一些,如:糖化细菌门螺旋体菌门、厚壁菌门、装甲菌门、衣原体门、俭菌总门、迷踪菌门、衣原体门、迷踪菌门、Ignavibacteriae、杂食菌门(Omnitrophica)等,相对丰度之和为2.08%。其中相对丰度超过7%的门有变形菌门、放线菌门和酸杆菌门。结构调整后样地细菌类群和对照样地一样,主要由这三个菌门的细菌构成(图1a)。
由图2(a)可以看出,进行结构调整后,土壤微生物类群发生一定的变化,在门水平上,TZ样地的土壤细菌变形菌门、酸杆菌门要高于对照样地,而TZ样地的放线菌门、浮霉菌门、拟杆菌门要低于对照样地CK。
-
油松人工林未进行结构调整的CK对照样地,共采集到真菌涉及14门42纲111目(图1b),CK油松纯林中的主要真菌门类为:子囊菌门(Ascomycota,51.7%)、担子菌门(Basidiomycota,24.42%)、被孢菌门(Mortierellomycota,16.32%),另外还检测到一些如:尾虫门(Cercozoa)、球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota)、梳霉门(Kickxellomycota)、罗兹菌门(Rozellomycota),毛霉门(Mucoromycota)、Calcarisporiellomycota、GS19等,相对丰度之和为:0.93%。其中相对丰度超过7%的门有子囊菌门、担子菌门、被孢菌门。
结构调整后的油松纯林TZ样地经过数据质控和去除嵌合体,共获得真菌OTU 5 926个,涉及15门44纲116目,相对丰度超过7%的主要真菌门类为:子囊菌门(44.22%)、担子菌门(39.48%)、被孢菌门(9.35%)(图1b)。另外还检测到一些如球囊菌门(1.32%)、尾虫门、壶菌门、罗兹菌门、梳霉门、毛霉门等,相对丰度之和为0.75%。
由图2b可以看出,在土壤微生物真菌门水平上,结构调整后的TZ样地子囊菌门,被孢菌门要低于CK样地,而结构调整后TZ样地的担子菌门要高于对照CK样地。说明结构调整后土壤真菌类群结构也产生相应变化。
-
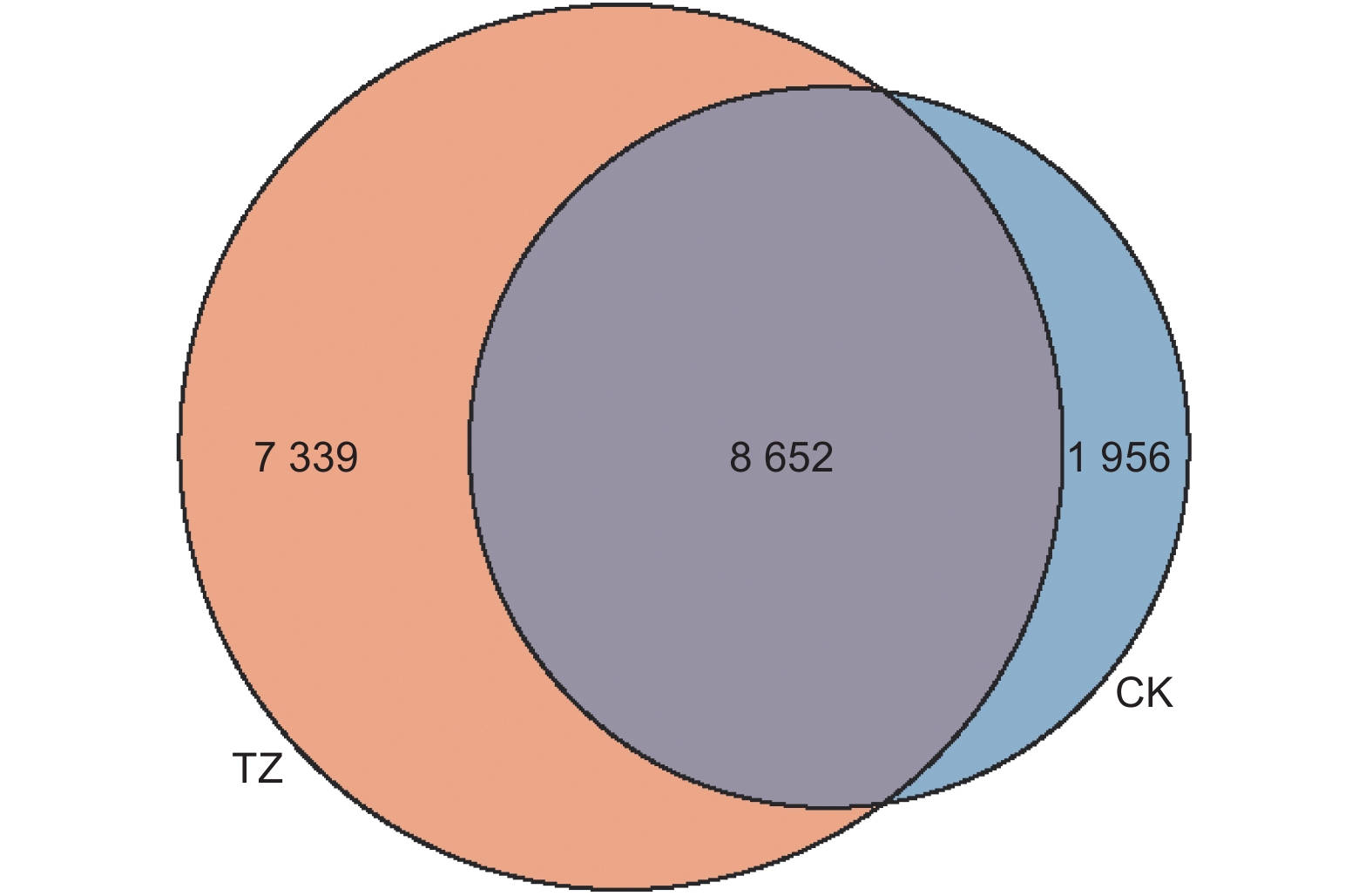
对多个样品中所共有的OTU数目进行统计以反映样品的相似性以及重叠情况。对各样本细菌OTU矩阵进行分析(图3),各样地细菌OTU数量总计为17 947 个,其中共有OTU 8 652 个,占比48.21%。对照样地的独有OTU 1 956个,占比10.90%;结构调整后样地独有的OUT为7 339 个,占比40.89%,高于对照样地29.99%,结构调整后TZ样地独有土壤细菌OUT占比明显高于CK样地。
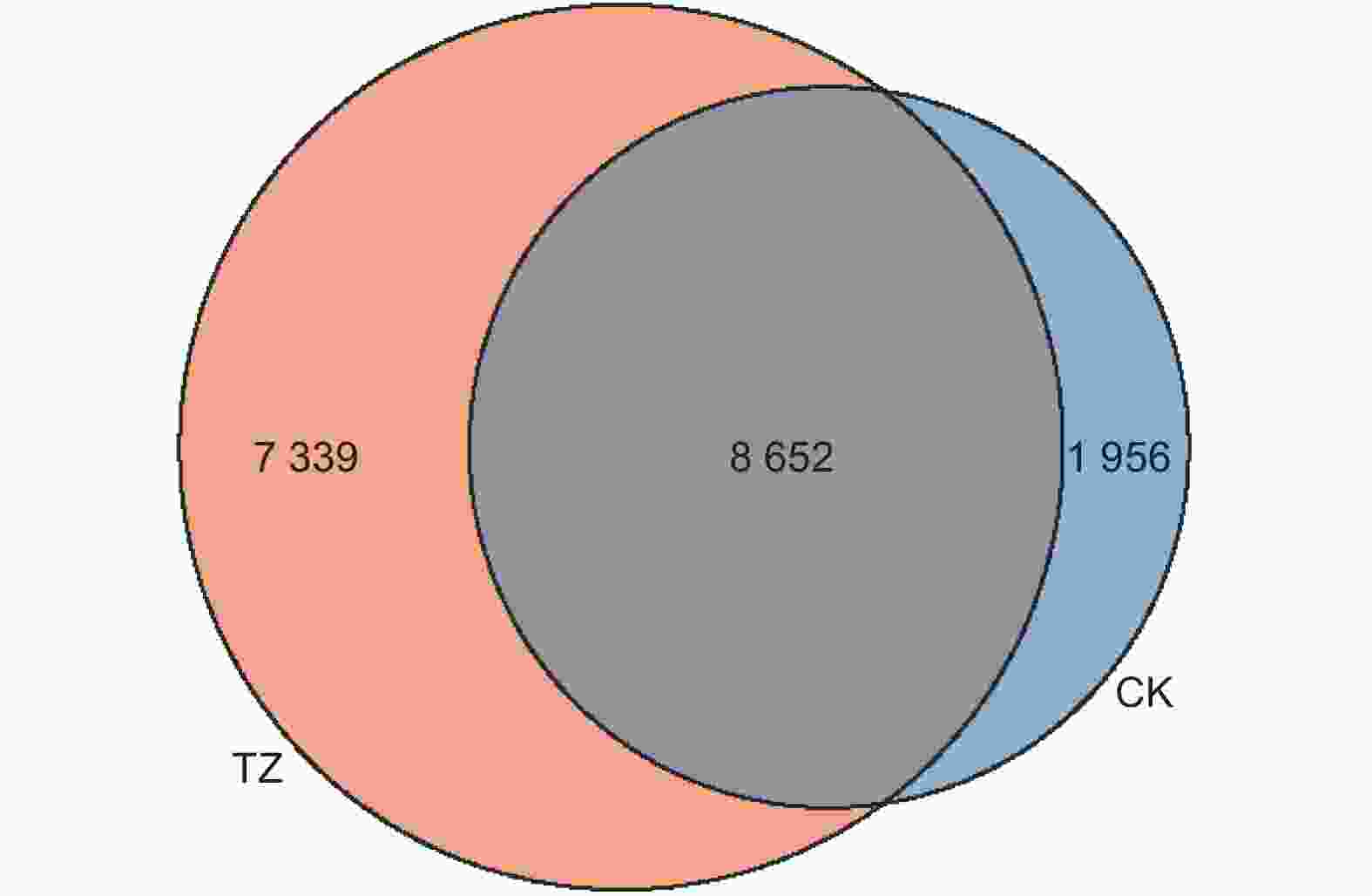
Figure 3. Venn diagram of soil bacterial community in Pinus tabulaeformis plantations before and after structural adjustment
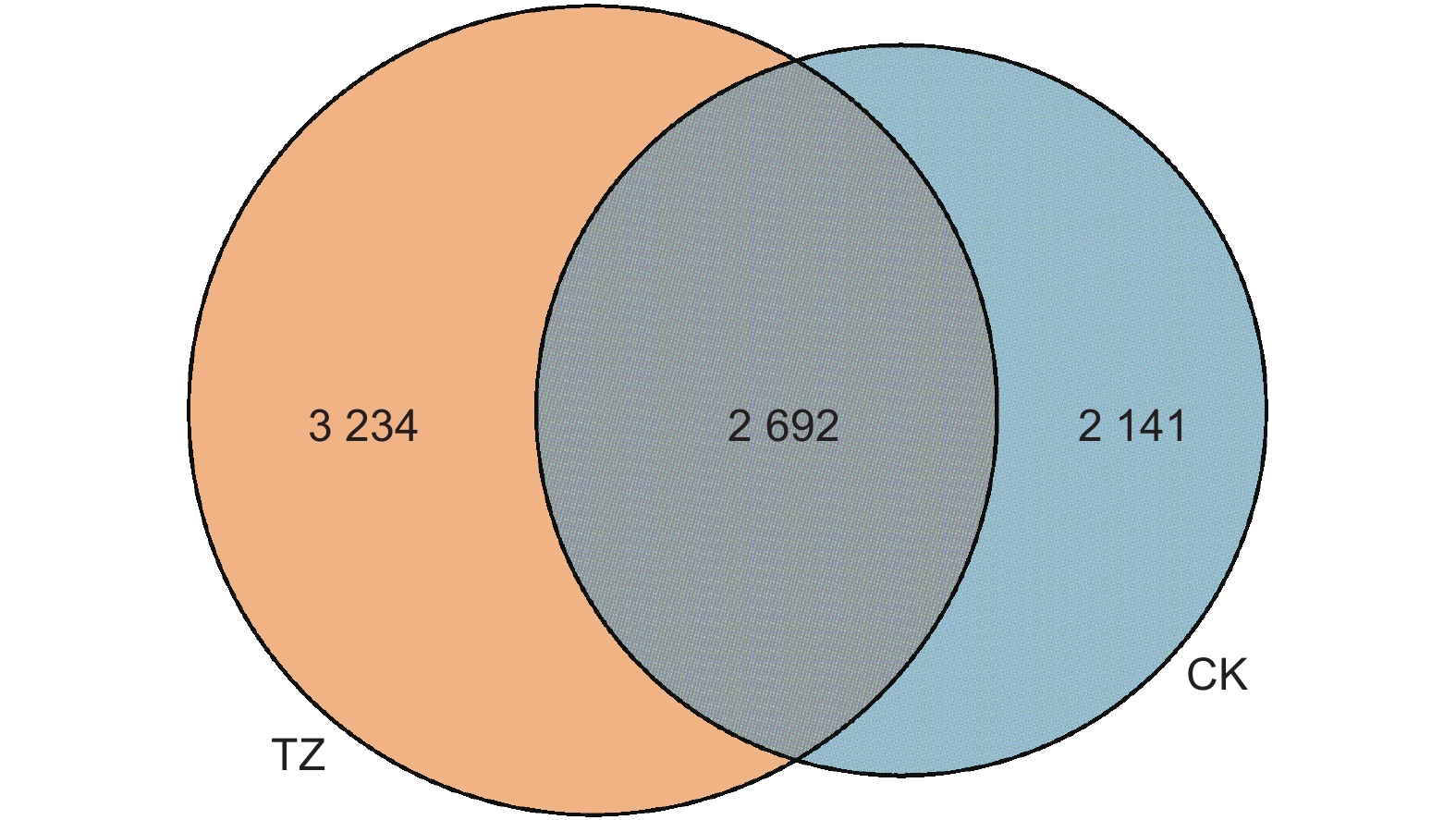
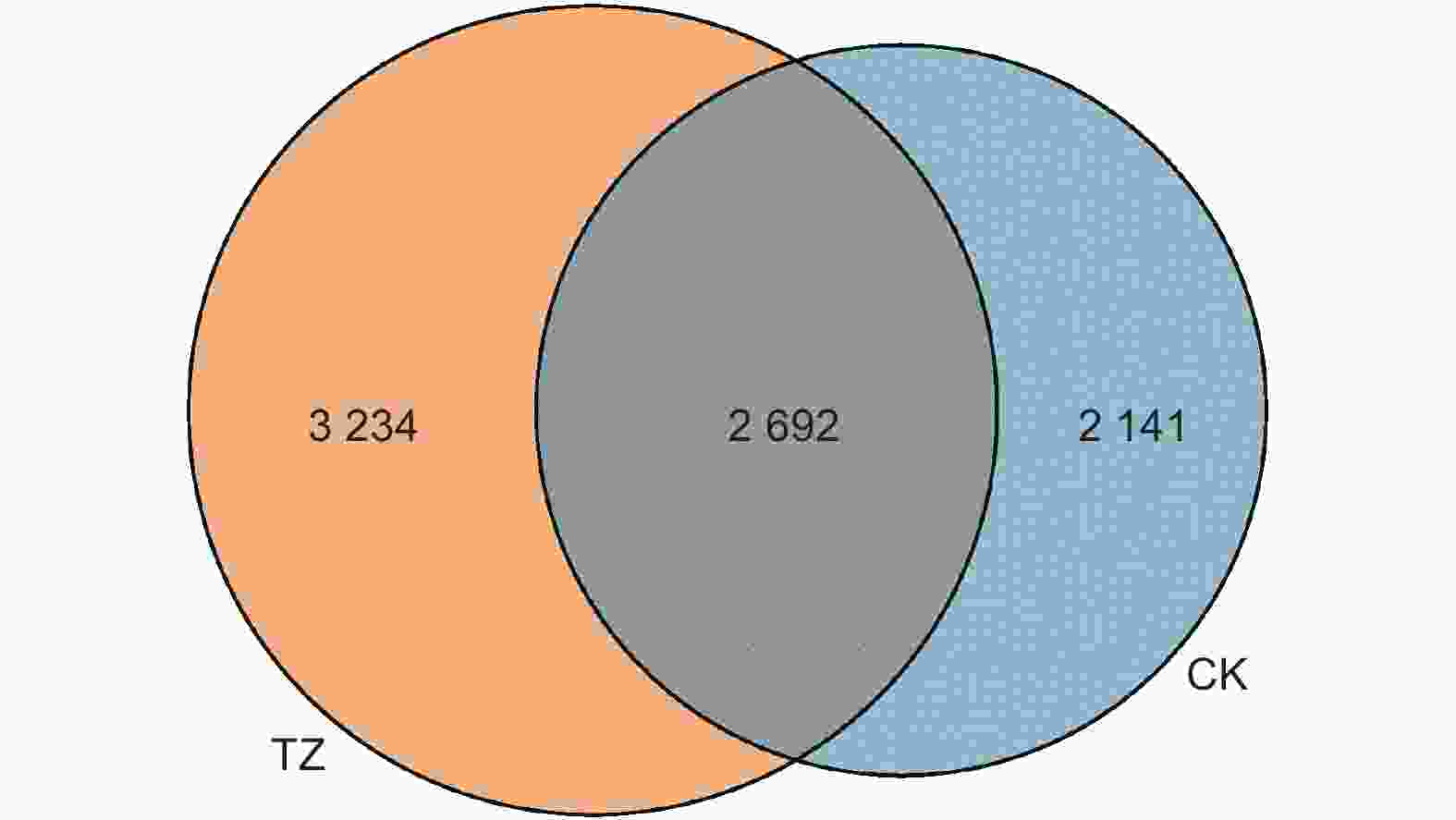
对各样本真菌OTU矩阵进行分析(图4),各样地真菌总计OTU数量为8 067 个,其中共有OUT为2 692 个,占比33.37%,对照样地CK独有OTU 2 141 个,占比26.54%;结构调整后样地独有的真菌OUT为3 234 个,占比40.09%,高于对照样地的13.55%。结构调整后TZ样地独有真菌OUT占比明显高于CK样地。
-
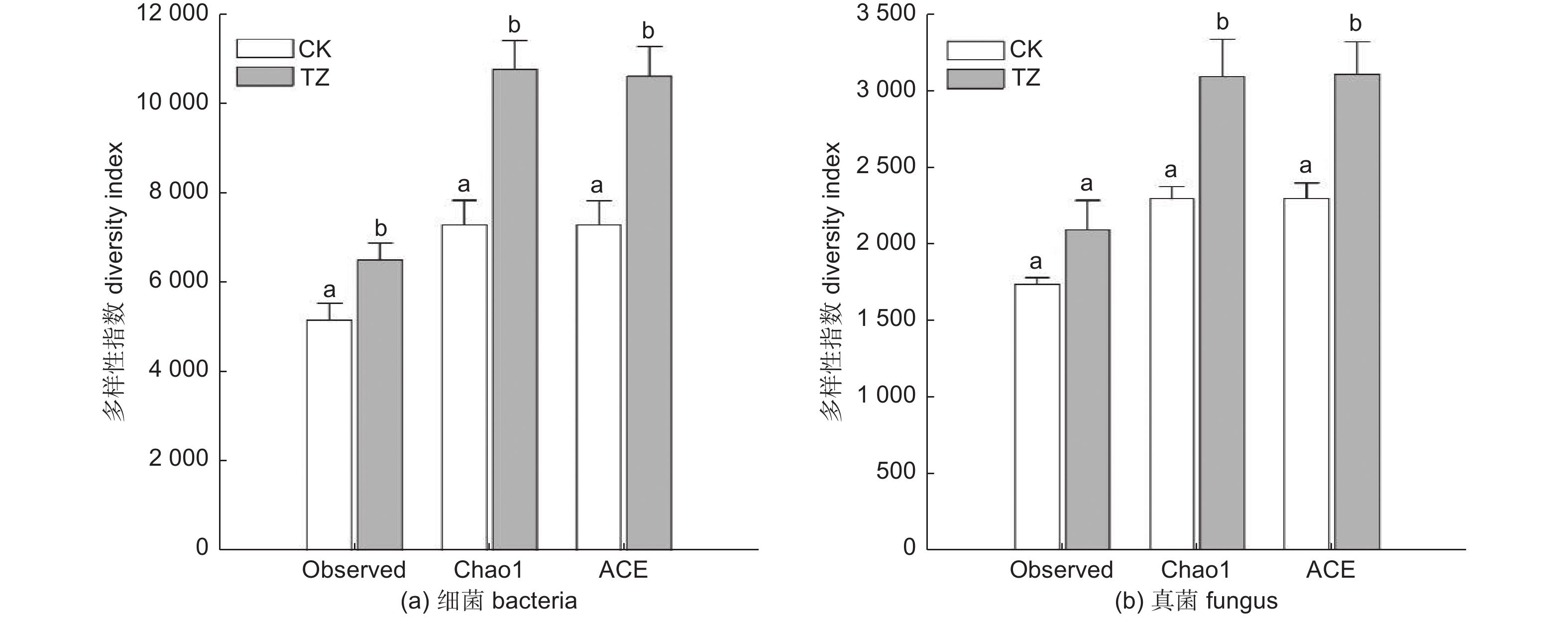
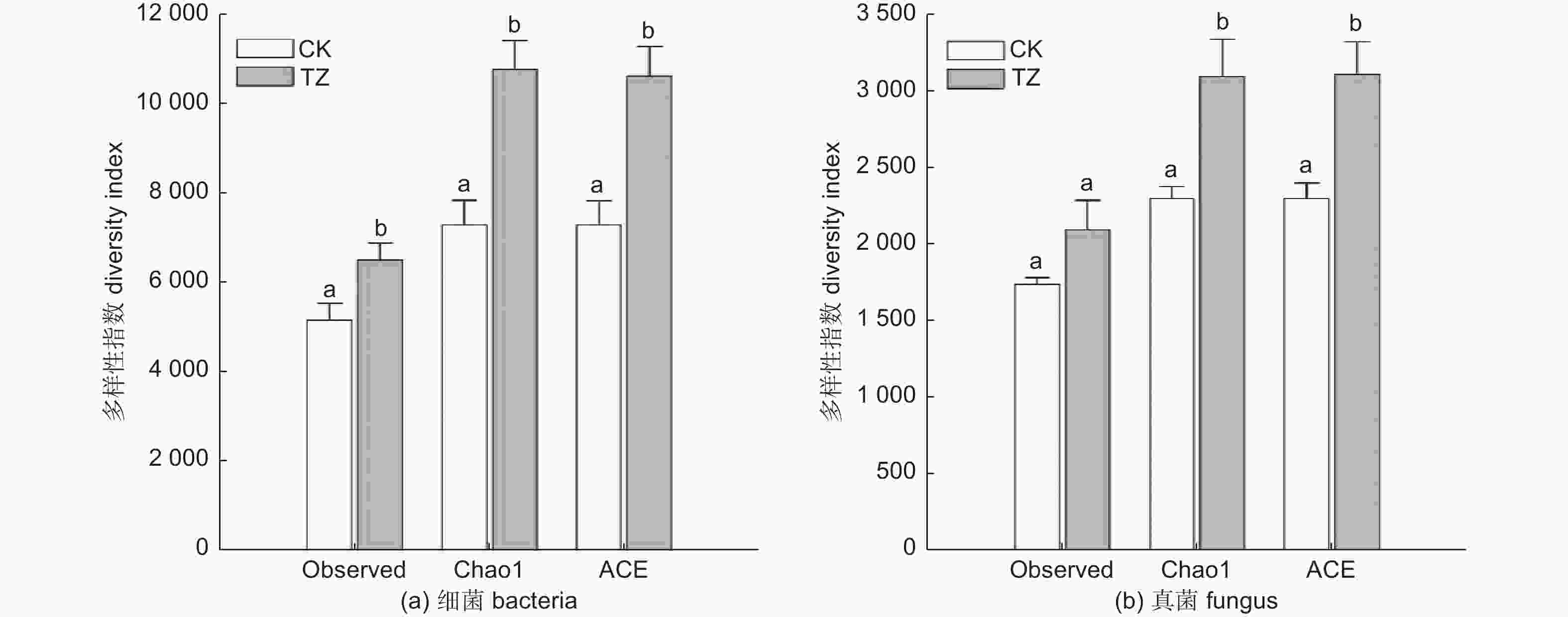
由表3可知油松人工林进行结构调整后,土壤菌群的丰富度和多样性有所改变。相较于对照样地,结构调整后,土壤中观察到的细菌OUT总数和真菌OUT总数均大于调整前。结构调整后的油松人工林样地土壤细菌类群和真菌类群的Chao1指数都显著高于调整前。结构调整后的油松人工林样地土壤ACE指数也要显著高于调整前(p<0.05)(图5a、b)。由此可见,结构调整后,土壤微生物群落的丰富度比调整前有了显著提升,土壤微生物群落更加丰富。结构调整后油松人工林的土壤真菌与细菌的多样性(Shannon和Simpson指数)在结构调整前后差异不显著(p>0.05)(表3)。
类型
Microbial type林型
Forest typeObserved Chao1 ACE Shannon Simpson 真菌
FungiTZ 2 085.33 ± 192.18 a 3 085.36 ± 243.23 a 3 098.72 ± 211.11 a 4.67 ± 0.23 a 3.29 × 10−2 ± 6.28 × 10−3 a CK 1 730.83 ± 44.31 b 2 287.53 ± 82.00 b 2 290.22 ± 98.74 b 4.79 ± 0.04 a 2.25 × 10−2 ± 3.89 × 10−4 a 细菌
BacteriaTZ 6 530.5 ± 371.93 a 10 787.59 ± 637.49 a 10 635.7 ± 656.84 a 6.91 ± 0.06 a 3.83 × 10−3 ± 2.51 × 10−4 a CK 5 185.17 ± 376.38 b 7 315.26 ± 548.3 b 7 309.20 ± 540.79 b 6.76 ± 0.10 a 3.85 × 10−3 ± 6.49 × 10−4 a Table 3. Soil microbial community richness and diversity index before and after structural adjustment
-
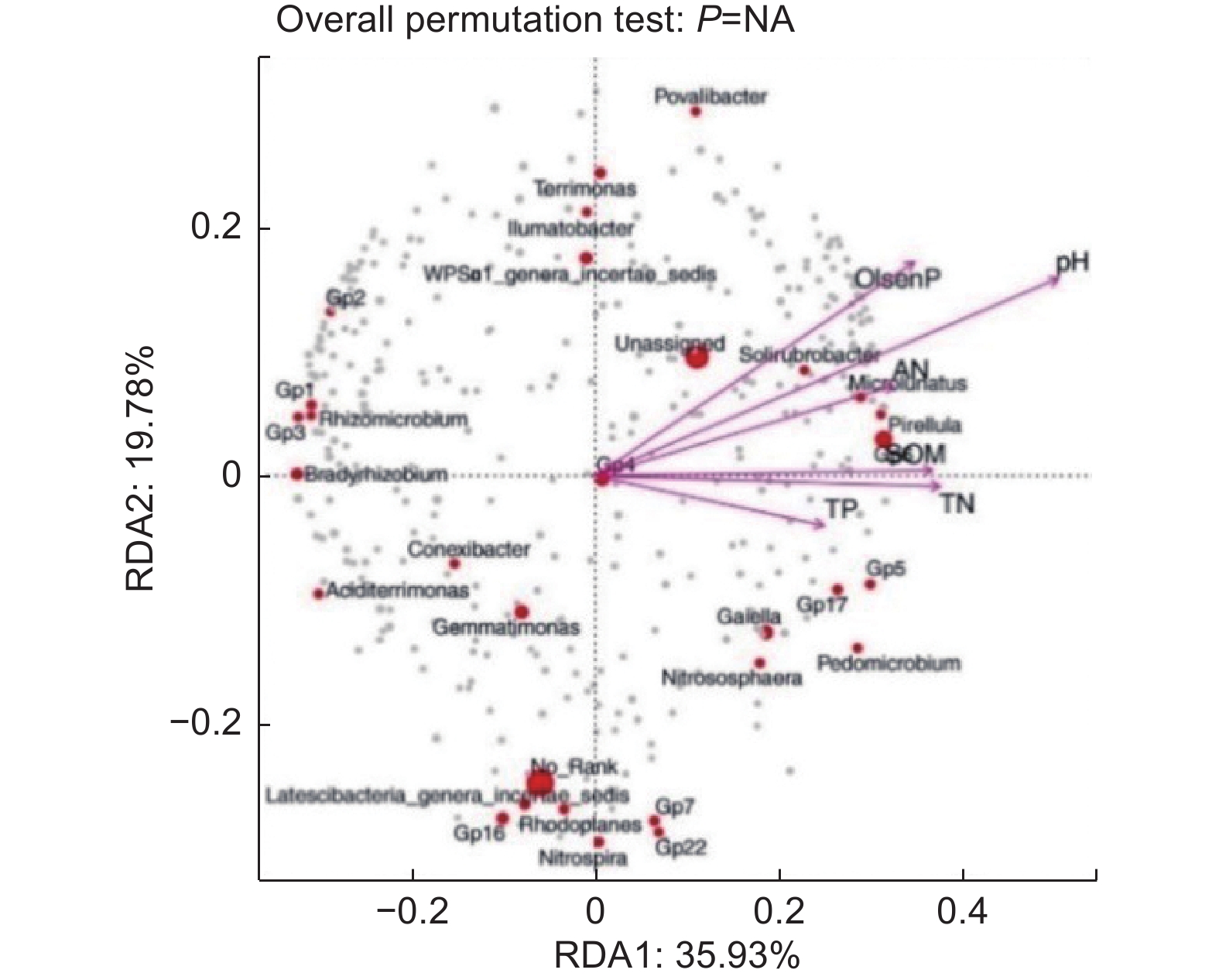
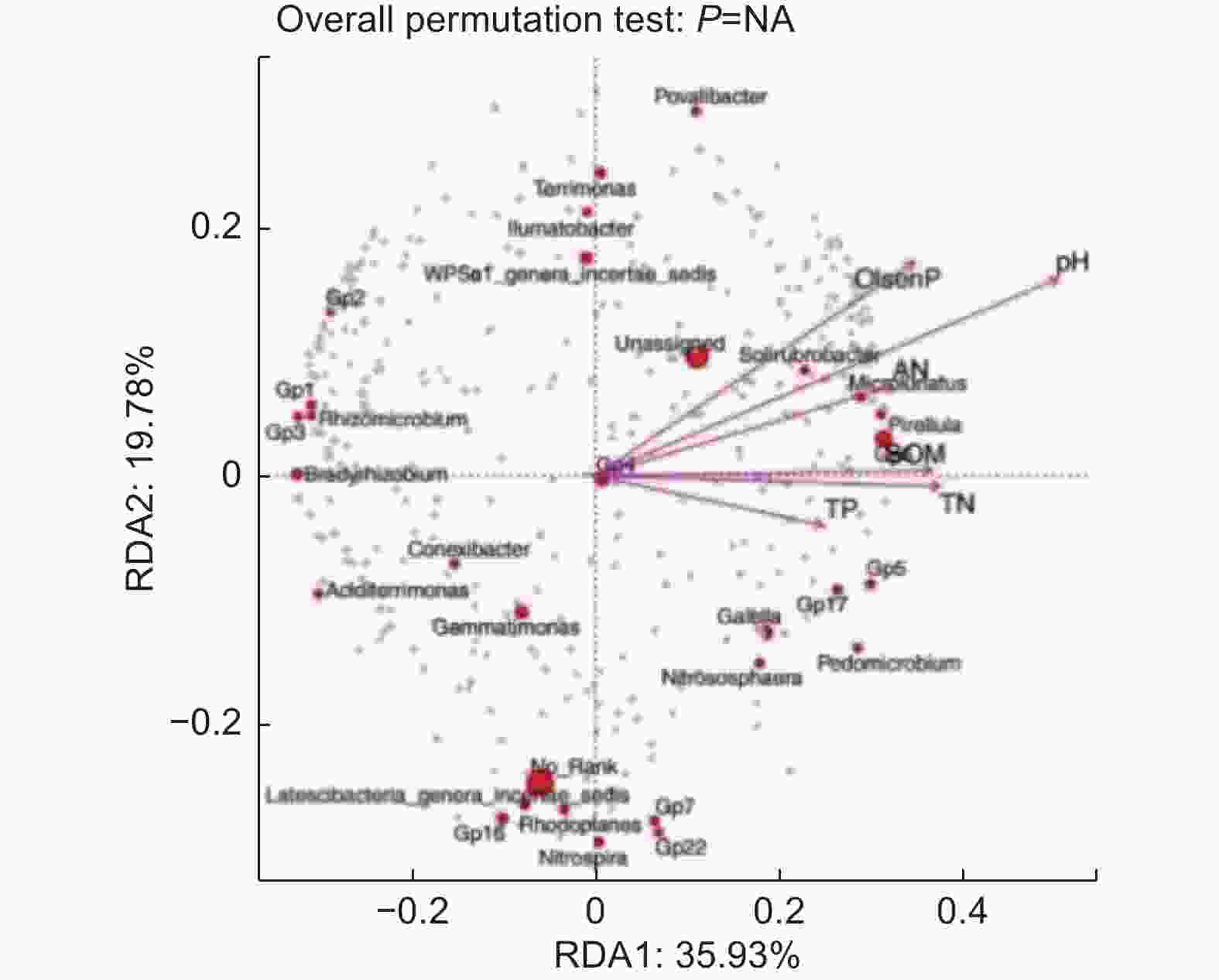
为研究油松人工林下土壤微生物与土壤环境因子的关系,对油松人工林CK与TZ样地基于OTU水平细菌群落与土壤理化性质进行RDA分析,对于油松人工林土壤细菌群落与环境的RDA分析显示(图6),RDA前两个排序轴分别解释了35.93%、19.78%的细菌多样性变化,6 个主要的土壤理化因子共解释了55.71%的总特征值,表明前两轴的贡献值可以较好地解释各因子对土壤细菌群落结构的影响。结构调整对油松对人工林下细菌群落有显著性影响。其中对土壤细菌多样性影响较大的有SOM(r2=0.64),TN(r2=0.66),TP(r2=0.44),AN(r2=0.59),pH(r2=0.93),与第一轴的相关性较大。速效磷(r2=0.68)与轴2的相关性较大。pH、SOM、TN、AN、速效磷是影响油松人工林下细菌类群变化的主要驱动因子(p<0.05),具有显著的协同作用。
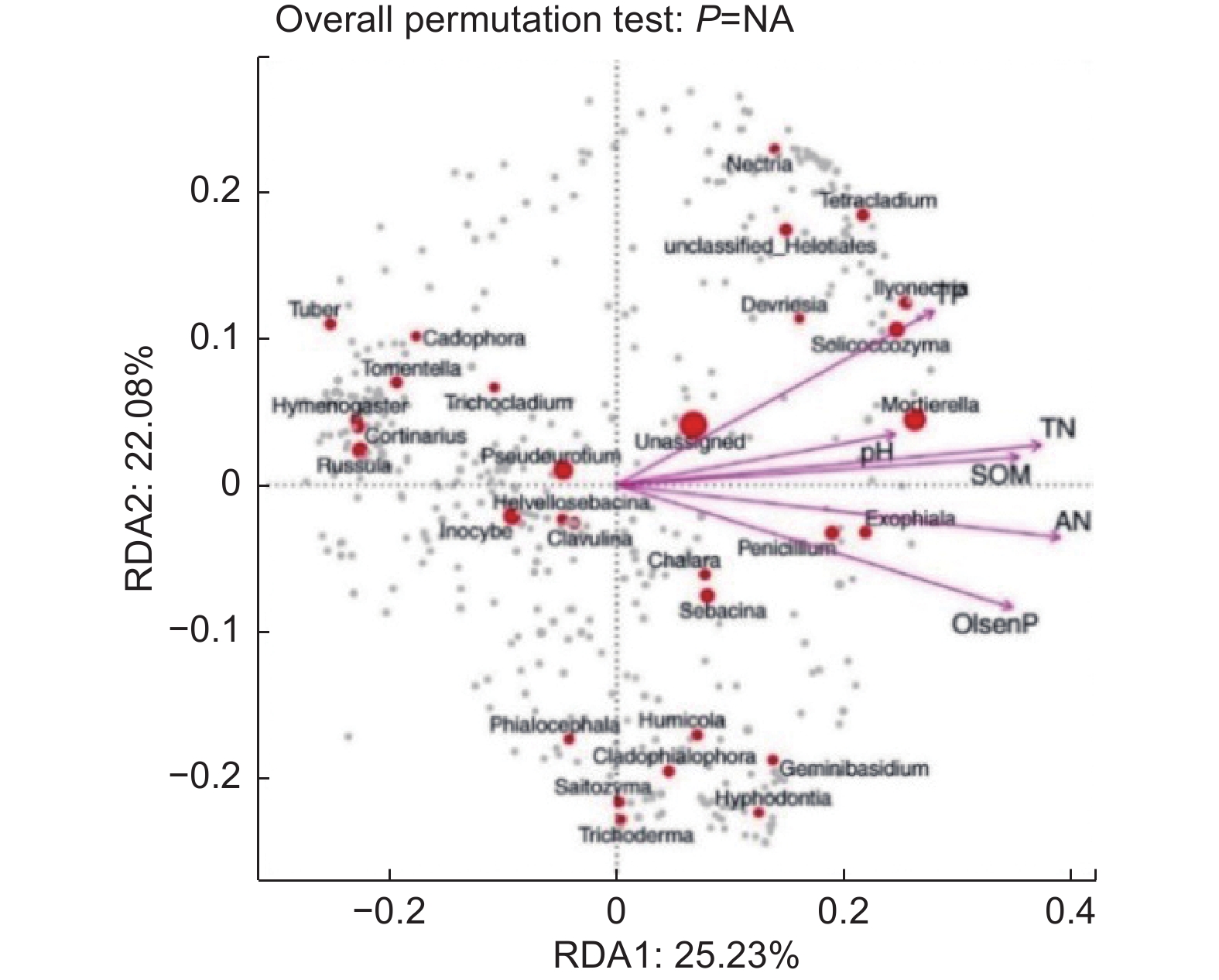
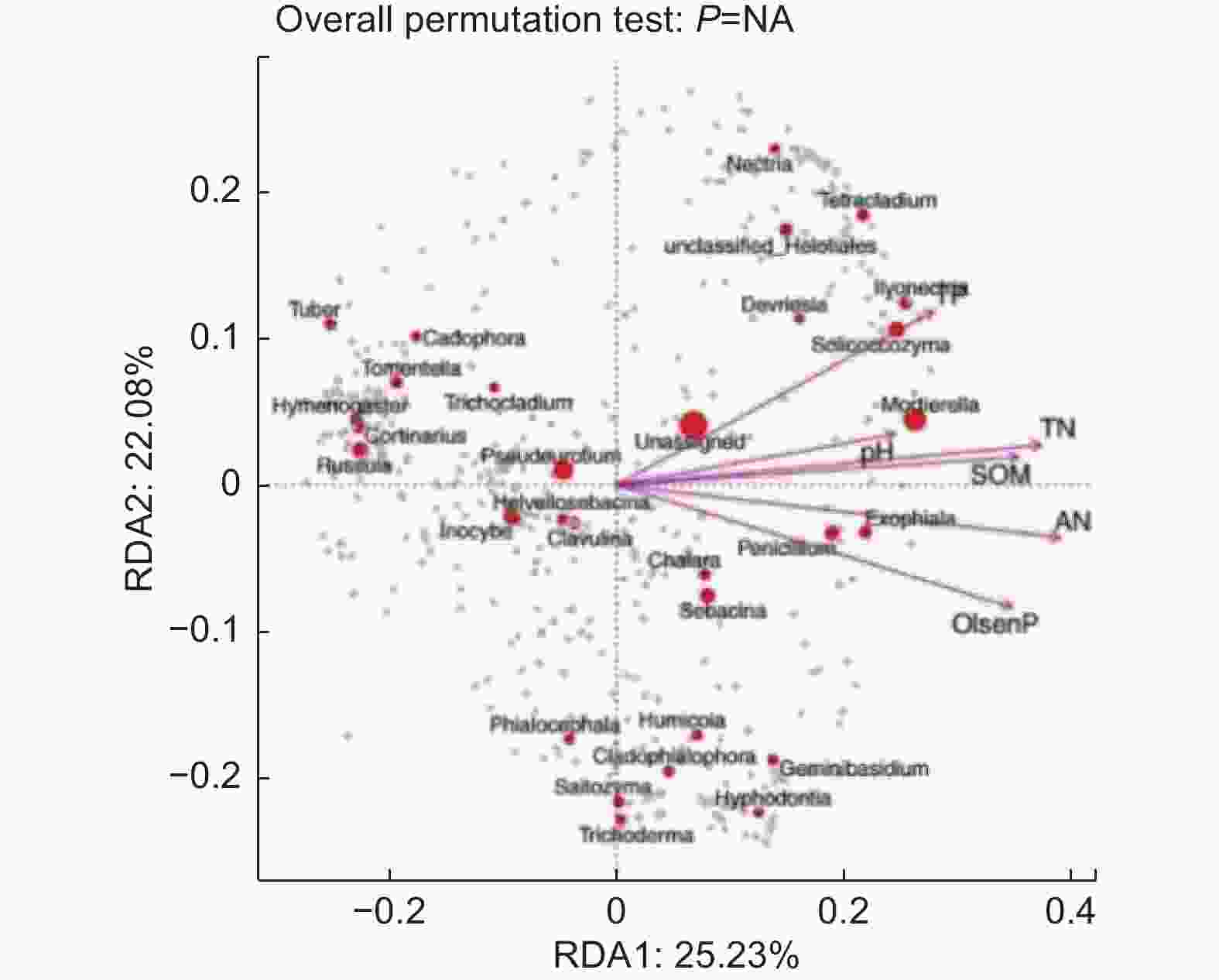
基于OTU水平真菌群落与土壤理化性质进行RDA分析,对于油松人工林下的真菌群落(图7),RDA前两个排序轴分别解释了25.23%和22.08%的真菌多样性变化,解释了47.31%的总特征值,其中对土壤真菌多样性影响较大的有SOM(r2=0.87)、TN(r2=0.92)、AN(r2=0.96)、pH(r2=0.61)和Olsen-P(r2=0.88),与第一轴的相关性较大。TP(r2=0.75)与第二轴的相关性较大。表明SOM、TN、TP、AN、pH和Olsen-P是驱动油松人工林林下土壤真菌类群变化的主要因子。SOM、TN、TP、AN、和Olsen-P(p<0.05)具有显著的协同作用。
对油松人工林土壤微生物多样性和土壤化学性质进行Pearson相关分析,结果(表4)显示,细菌群落Observed、Chao1、ACE与SOM、TP呈现显著负相关(p<0.05),与TN、AN呈现极显著负相关(p<0.01),细菌群落Simpson多样性与pH值呈现显著负相关(p<0.05),Shannon多样性与C/N呈现显著正相关(p<0.05)。真菌群落的Observed、Chao1、ACE与TN、AN呈现显著负相关(p<0.05),而Simpson和Shannon多样性与环境的相关性不明显(p>0.05)。
Pearson相关性
Pearson correlation有机质
SOM/(g·kg−1)全氮
TN/(g·kg−1)全磷
TP/(g·kg−1)速效氮
AN/(g·kg−1)速效磷
Olsen-P/(g·kg−1)pH C/N 细菌
bacteriaObserved −0.829* −0.943** −0.886* −0.943** −0.657 −0.429 0.643 Chao1 −0.829* −0.943** −0.886* −0.943** −0.657 −0.429 0.538 ACE −0.829* −0.943** −0.886* −0.943** −0.657 −0.429 0. 538 Shannon −0.486 −0.657 −0.771 −0.657 −0.086 0.143 0.797* Simpson −0.314 −0.257 −0.086 −0.257 −0.657 −0.886* 0.086 真菌
fungusObserved −0.771 −.0829* −0.714 −0.829* −0.6 −0.314 0.314 Chao1 −0.771 −0.829* −0.714 −0.829* −0.6 −0.314 0.314 ACE −0.771 −0.829* −0.714 −0.829* −0.6 −0.314 0.314 Shannon 0.143 −0.143 −0.314 −0.143 0.2 −0.086 0.6 Simpson −0.6 −0.543 −0.257 −0.543 −0.771 −0.257 −0.143 注/Notes: **p<0.01,*p<0.05 Table 4. Correlation between soil bacterial diversity and soil chemical properties
-
本文对油松人工林结构调整干扰后的林下土壤微生物类群特征进行了研究,鉴定出变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)等均是油松人工林CK与TZ样地的优势菌门。研究显示,植被类型及组成种很大程度上能够决定土壤细菌和真菌的群落结构[19],所以,进行结构调整虽然会对森林结构、植被覆盖率等产生一定的影响,但调整前后油松人工林依然具有类似的生境,所以两个样地仍具有相似的微生物群落组成结构,但在不同层次分类水平上的丰度不同。
对油松人工林进行以目标树经营为主的多次结构调整后,森林郁闭度降低,林下的微气候环境随之发生了改变,植被光合作用增强,提高了对土壤养分的利用率,根系分泌物变化,影响了土壤微生物群落。变形菌门属于异养型细菌[20],该门类包含很多能与植物共生的固氮细菌,有益于土壤固氮[21]。油松人工林进行结构调整后,土壤细菌变形菌门高于对照样地CK。可见多次结构调整能够提高油松人工林土壤中固氮菌的比例。酸杆菌门在酸性条件下的相对丰度较高[22]。油松人工林进行多次结构调整后,土壤pH值较调整前的对照样地有所降低,更适于酸杆菌门的生存,说明多次结构调整后,油松人工林土壤养分环境出现酸化的倾向,更适合酸杆菌门的生存。
放线菌是土壤中最重要的有机质分解者之一[23]。是常见的k策略细菌[24],降解稳定的高分子化合物[25]。油松人工林进行多次结构调整后,密度大幅降低,枯落物减少,土壤碳输入降低。放线菌宜在有氧环境中生活[26],油松人工林土壤经多次人为活动干扰后更为紧实,土壤氧含量降低,导致放线菌数量受影响降低。变形菌门属于典型的r策略细菌[27],一些容易分解的有机质会刺激r对策的细菌快速增长。结构调整提高了油松人工林对养分和光照的利用率,促进了油松根系的进一步生长,产生的根系分泌物会刺激r对策的变形菌门增加[35],这类细菌的增长放过来也会导致对土壤有机质的降解的增加。变形菌门细菌的增加表明土壤微生物细菌类群在向固氮和更利于土壤有机质分解的方向转化。
-
森林土壤真菌主要利用植物凋落物及根系分泌物来维持生活,凋落物的丰富程度和品质高低直接决定微生物的数量及群落结构[28]。TZ样地与CK样地土壤真菌在组成上具有一定的相似性,均是子囊菌门为优势菌种,担子菌次之,但在门、纲和属的相对丰度上存在一定差异,这种相似性可以作为衡量土壤稳定性的指标。该研究结果与湖南杉木人工林[29]、关帝山森林土壤[30]、辽西北风沙区[31]土壤中优势真菌门类群相一致。担子菌和子囊菌在通气好的土壤条件下生长较好[32],构成了油松人工林下土壤有机质的主要分解者[33]。担子菌门一般与植物根系形成共生,结构调整后,油松人工林林分密度降低,林下清理较为干净,油松根系进一步发展,更利于担子菌的生长。子囊菌多分解油松人工林凋落物中难以分解的木质素、单宁、树脂和蜡质等物质。结构调整后油松人工林凋落物输入减少,土壤有机质降低,C/N增加,pH降低,土壤偏酸化,表明土壤分解难度增加,这对腐生性真菌影响最大[34]。子囊菌是营腐生、寄生等方式的微生物,受土壤环境影响而丰富度降低。多次结构调整后,子囊菌门,被孢菌门均低于CK样地,土壤担子菌丰度的增加,林下土壤真菌类群由子囊菌占主导地位向担子菌子囊菌共同占主导的方向转变。
-
油松人工林进行多次结构调整后,采伐活动带来的土壤扰动以及植被损失造成一定的水土流失,同时油松人工林内密度降低,空隙增大,更利于目标树的生长,加剧了根系对养分的摄取。TZ样地内土壤养分含量显著低于CK样地(p<0.05),导致油松人工林土壤微生物的类群结构也随之发生明显变化,TZ样地土壤微生物的种类和数量都要高于CK样地,样地细菌和真菌的独有种类也大于对照样地,与万盼的研究结果类似[2]。土壤微生物多样性Shannon指数和Simpson指数无显著差异,但Chao1指数和ACE指数显著高于CK样地,表明结构调整前后,油松人工林均能保持土壤生态系统的功能多样性,但结构调整导致林内土壤微生物的丰富度显著提升,增加了地下的生态位。结构调整后油松人工林样地土壤pH值低于对照样地,土壤细菌的群落多样性与SOM、TN、TP、AN和pH值、C/N呈现显著的相关性,而真菌的多样性则与TN和AN显著相关,机构调整后细菌对土壤养分环境更为敏感,这可能与真菌群落对土壤pH适应范围较宽有关[31],真菌是生态幅度较广的菌群,而细菌则比较敏感[35]。RDA分析显示,pH、SOM、TN、AN是驱动油松人工林林下土壤微生物类群变化的主要驱动因子。结构调整后土壤有机质和TN、AN显著低于对照样地。
-
油松人工林生长过程中,结构的不合理会导致林分问题逐渐凸显,进行结构调整有助于提高林分质量。进行多次结构调整后,土壤微生物类群结构发生了明显变化。(1)土壤微生物类群结构较CK样地更加丰富,固氮菌比例提高,微生物多样性增加,表明多次结构调整后土壤微生物未趋于稳定,仍处于恢复阶段;(2)采伐扰动带来的养分变化影响了土壤微生物的生存环境,更利于适应酸性环境的微生物生存,使微生物类群向更利于土壤有机质分解的方向转化;(3)pH、SOM、TN、AN是驱动油松人工林林下土壤微生物类群变化的主要驱动因子。因此,在进行多次结构调整后的恢复期要注意改善土壤养分条件,增强土壤微生物类群的稳定性和多样性,有助于提高油松人工林生态系统的稳定。
致谢:感谢京津冀华北平原森林生态系统国家定位观测研究站。
Dynamics of Soil microbial Groups in Pinus tabulaeformis Plantation in Response to Stand Structure Adjustment
- Received Date: 2023-10-07
- Accepted Date: 2024-03-13
- Available Online: 2024-03-01
Abstract:





 DownLoad:
DownLoad: