-
磷是植物生长和发育的重要营养元素之一,参与植物的重要代谢途径,如光合作用,养分吸收及细胞分裂[1-2]。然而土壤中的磷大部分是难以利用的难溶性磷酸盐,可被植物直接吸收利用的水溶态磷含量低,土壤磷利用率通常只有10%~15%,少部分植物利用率达到25%[3-4]。因此,磷常常成为限制植物生产力的主要因素之一。杉木是我国南方特有的速生用材树种,木材产量超过了全国商品用材的四分之一[5]。然而南方地区淋溶强烈,土壤富含铝离子和铁离子,磷极易被固定,土壤磷利用率极低,严重制约了杉木人工林可持续发展[6]。因此,越来越多的研究已经转向土壤磷可持续利用。众多研究发现,土壤中存在大量具有溶磷能力的微生物,这些微生物通过自身代谢作用,将土壤中的难溶性磷酸盐转化为植物可吸收利用的水溶性磷[7-9]。开发利用溶磷微生物,提高土壤磷利用率,已经成为当前研究热点。目前大多数报道的溶磷微生物菌分离自农作物,Mukhtar[10]等从甘蔗根际分离出2株高效溶磷细菌,均属芽孢杆菌属(Bacillus),Zhao等[11]从玉米根际筛选到1株耐盐的洋葱伯克氏菌(Burkholderia cepacia)。
红壤是我国杉木种植区主要土壤类型之一,具有“酸”、“粘”、“瘦”的特点,土壤磷素有效性低,严重制约着杉木生产力的提高[12]。本研究从红壤地区杉木人工林土壤分离筛选溶磷细菌,通过生理生化和16SrDNA基因序列确定其分类地位,运用单因素试验和正交试验优化培养条件,为杉木菌肥的开发利用提供高效溶磷菌株。
HTML
-
土壤样品采自江西省大岗山山下林场(27°36′ N,114°24′ E)18年生杉木人工林,该区域属于低山丘陵地貌,海拔220~300 m,土壤类型为红壤。通过S形采样法在样地内布设7个采样点,用土钻钻取0~20 cm土壤,将7个采样点土壤混合装入灭菌袋后立即带回实验室,4℃保存。称取10 g新鲜土样,置于装有90 mL无菌水的三角瓶中,振荡30 min。将土壤悬浮液连续稀释10倍至10−4,取0.05 mL稀释度为10−3、10−4土壤悬浮液涂布于Pikovskaya(PVK)[13]琼脂平板上,28℃培养5~7 d,检查平板是否存在产生透明晕圈的菌落。挑取溶磷圈明显的菌落,用连续划线法进一步纯化。
采用钼锑抗比色法[14]对菌株溶磷能力进行测定:在250 mL三角瓶中加入100 mL PVK液体培养基(磷酸钙灭菌后加入),接入1 mL培养过夜的菌液,置于恒温摇床中28℃,180 r·min−1培养7 d后测定菌株溶磷能力。
-
根据伯杰细菌鉴定手册,研究菌株的生理生化特性。采用试剂盒法提取细菌基因组DNA,PCR扩增后进行16SrDNA测序。扩增引物为:27F:5′AGAGTTTGATCCTGGCTCAG3′;1492R:5′TACGGCTACCTTGTTACGACTT3′,扩增体系参考刘彩霞的方法[15]。测序结果在GenBank中进行比对,运用MEGA7构建系统发育树确定菌株分类地位。
-
根据溶磷能力测定的结果,选择溶磷能力强的菌株进行溶磷培养条件优化。为了验证菌株的溶磷能力,所有培养过程均采用PVK培养基。影响菌株溶磷能力的因素主要有培养时间、培养初始pH、培养温度、接种量、碳源、氮源、磷源。通过单因素试验,培养时间设置为24、48、72、96、120、144、168 h;培养基pH设置为4、5、6、7、8、9、10;培养温度设置为10、15、20、25、30、35、40℃;接种量设置为0.5、1、1.5、2、2.5、3、3.5、4%。分别以1%(w/v)、0.05%(w/v)、0.5%(w/v)的浓度提供不同碳源(葡萄糖、蔗糖、乳糖、麦芽糖、甘露醇、可溶性淀粉)、氮源(硫酸铵、硝酸钾、氯化铵、尿素、蛋白胨、酵母浸粉)、磷源(磷酸钙、磷酸铁、磷酸铝)。接种后置于恒温摇床中28℃,180 r·min−1培养7 d,测定培养基中菌株生长量、有效磷含量,以未接种PVK液体培养基为对照。菌株生长量通过测定培养液在波长600 nm时的光密度值表示(OD600)。有效磷含量采用钼锑抗比色法测定。
-
根据单因素试验的结果,设计了蔗糖(2.0%,2.5%,3.0%),氯化铵(0.1%,0.15%,0.2%),pH(5,5.5,6),温度(25℃,30℃,35℃)四因素三水平的正交试验对溶磷条件进行优化。选用L9(34)正交表,因素水平见表1。
水平
Level因素 Factor A蔗糖/%
SucroseB氯化铵/%
Ammonium chlorideC pH D温度/℃
Temperature1 2.0 0.10 5.0 25 2 2.5 0.15 5.5 30 3 3.0 0.20 6.0 35 Table 1. Factors and levels employed in orthogonal test
-
数据分析采用SPSS20.0软件进行方差分析(ANOVA)。
1.1. 菌株的分离与筛选
1.2. 形态观察及菌株鉴定
1.3. 菌株培养条件优化
1.3.1. 单因素试验
1.3.2. 正交试验
1.4. 数据分析
-
利用PVK平板分离杉木人工林土壤中的溶磷细菌,经过多次纯化得到13株具有明显溶磷圈的细菌。各菌株溶磷能力如表2所示,培养液中有效磷含量在21.61~195.61 mg·L−1之间,有效磷含量最高的是P5(195.61 mg·L−1)。因此,选择P5作为后续研究供试菌株。
菌株
Strain有效磷/(mg·L−1)
Available phosphorusP1 21.61±1.82 e P2 52.68±4.86 bc P3 45.67±3.94 c P4 39.62±3.59 cd P5 195.61±14.92 a P6 56.63±4.29 b P7 49.54±1.10 bc P8 46.54±3.01 c P9 36.63±2.85 d P10 24.13±1.81 e P11 50.77±2.45 bc P12 47.08±1.29 c P13 51.73±1.97 bc 注:同列不同小写字母表示不同菌株在同一测定指标中差异显著(P<0.05),下同。
Note:Different lowercase letters indicate significant differences in the same index (P<0.05). The same below.Table 2. Phosphorus solubilizing ability of bacterial strains
-
革兰氏染色试验表明菌株P5为革兰氏阴性菌,在PVK琼脂平板上28℃培养3 d后的菌落形态为圆形,边缘整齐,白色不透明且表面光滑湿润,具有明显溶磷圈。以下生理生化试验为阳性:硝酸盐还原试验,葡萄糖试验,阿拉伯糖试验,甘露醇试验以及柠檬酸盐试验。以下生理生化试验为阴性:甲基红试验,氧化酶/VP试验,硫化氢试验,明胶水解试验及丙二酸盐试验。
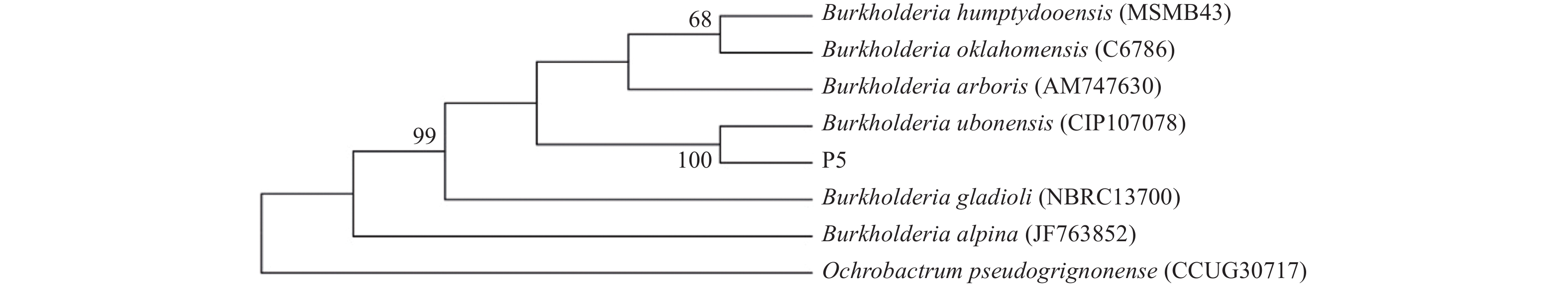
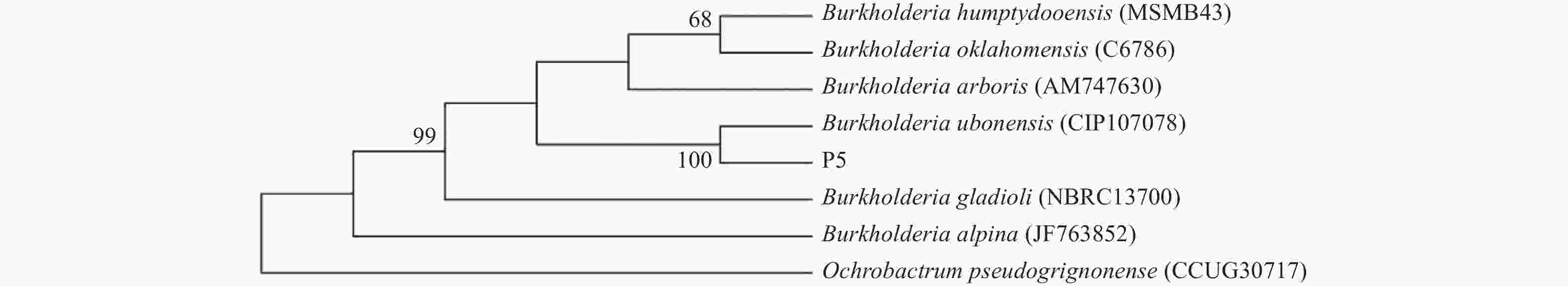
将菌株P5 16SrDNA序列与Genbank中的模式菌株序列进行比较,P5菌株与Burkholderia ubonensis序列相似度为99.09%,一致性为98.8%。选择数据库中相似度最高的7株标准菌株及1株外群菌株构建系统发育树,如图1所示。P5菌株与Burkholderia ubonensis同源,相似度和一致性均大于98%,置信度为78,结合生理生化判断P5为Burkholderia ubonensis。
-
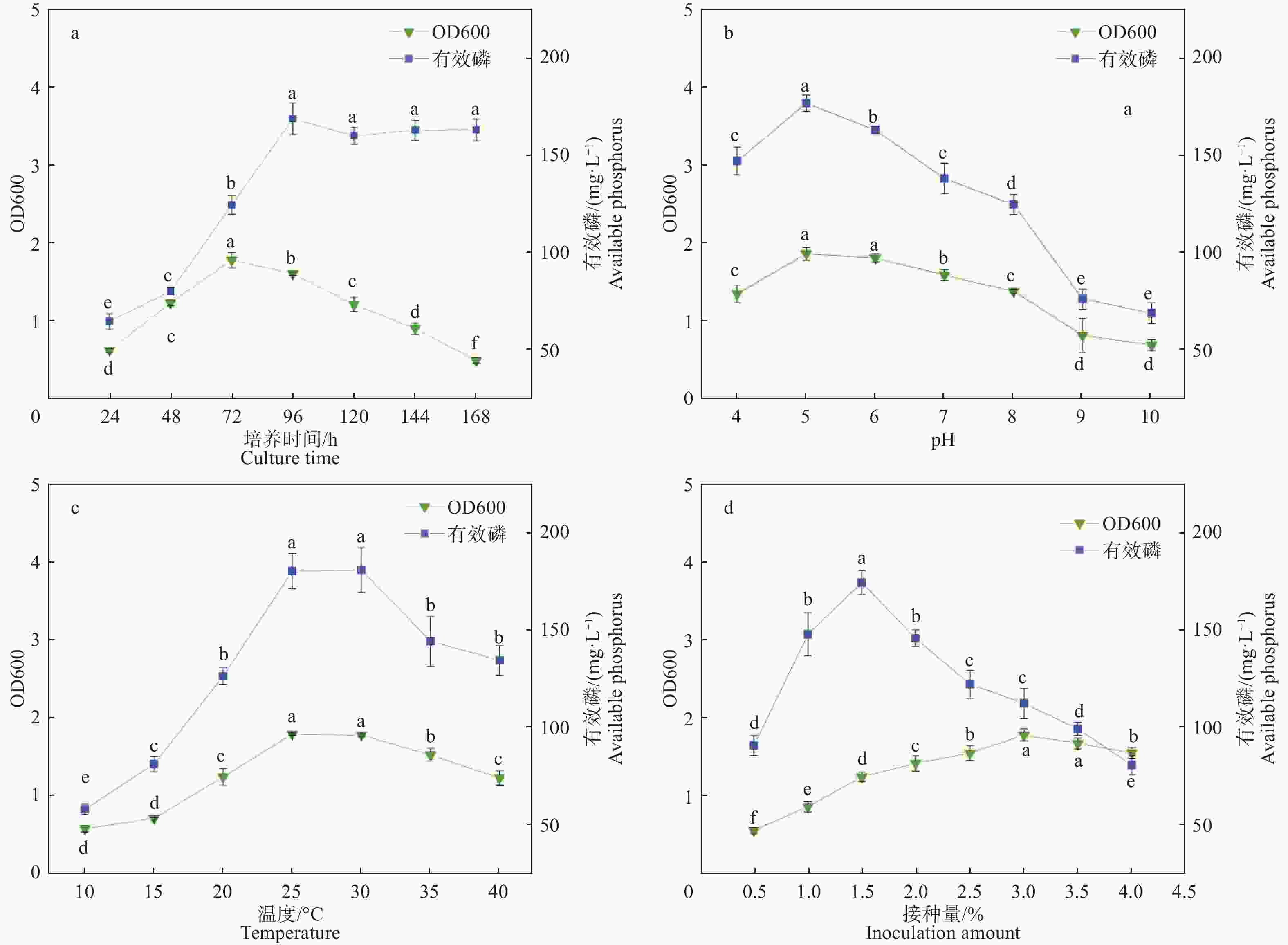
由图2可看出菌株生长量与有效磷含量对不同培养时间、pH、温度及接种量的响应有显著差异,但两者之间无明显相关性。培养时间对菌株溶磷量的影响如图2a所示,培养基中菌株生长量随着时间的增加先升高后降低,在72 h达到最大值,有效磷含量则在96 h达到最高后趋于平稳。从图2b可以看出pH在4~10范围内,有效磷含量和菌株生长量均呈现先上升后逐渐下降的规律,P5生长适应范围为5~6,最适pH为5。菌株生长量和有效磷含量在酸性条件下显著高于碱性条件,表明P5耐低pH。温度在10~40℃范围内,P5培养液中有效磷含量也呈现先上升后下降的趋势(图2c)。温度在25~30℃之间,菌株生长量和有效磷含量均达到最大值。在40℃时菌株光密度值OD600大于1,显著高于10~15℃,说明菌株较耐高温。菌株生长量和有效磷含量都随着接种量的增加先升高后降低(图2d)。菌株生长量在接种量为3%时达到了最高点,而有效磷含量在接种量为2%时达到最大值。单因素试验结果表明,菌株P5最适培养时间为72~96 h,最适pH为5~6,最适温度在25 ~30℃之间,最适接种量为1.5%。
6种不同碳源(葡萄糖、蔗糖、乳糖、麦芽糖、甘露醇、淀粉)对菌株溶磷能力的影响差异显著(图3a),葡萄糖、蔗糖作为唯一碳源时,有效磷含量和菌株生长量显著高于其余4种碳源。其中蔗糖是菌株P5的最佳碳源,其次为葡萄糖>麦芽糖>乳糖>甘露醇>淀粉。为了确定蔗糖浓度对菌株解磷能力的影响,在0.5%~4%(w/v)范围内设置8个浓度蔗糖(梯度为0.5%)。图3b表明随着蔗糖浓度的增加,有效磷含量逐渐增加,蔗糖浓度为3%时有效磷含量最高,浓度继续增加时有效磷含量无明显变化。菌株生长量随蔗糖浓度的增加先上升后下降,在浓度为1%~2%间达到最大值。不同蔗糖浓度下P5菌株生长量及溶磷量无明显相关性。
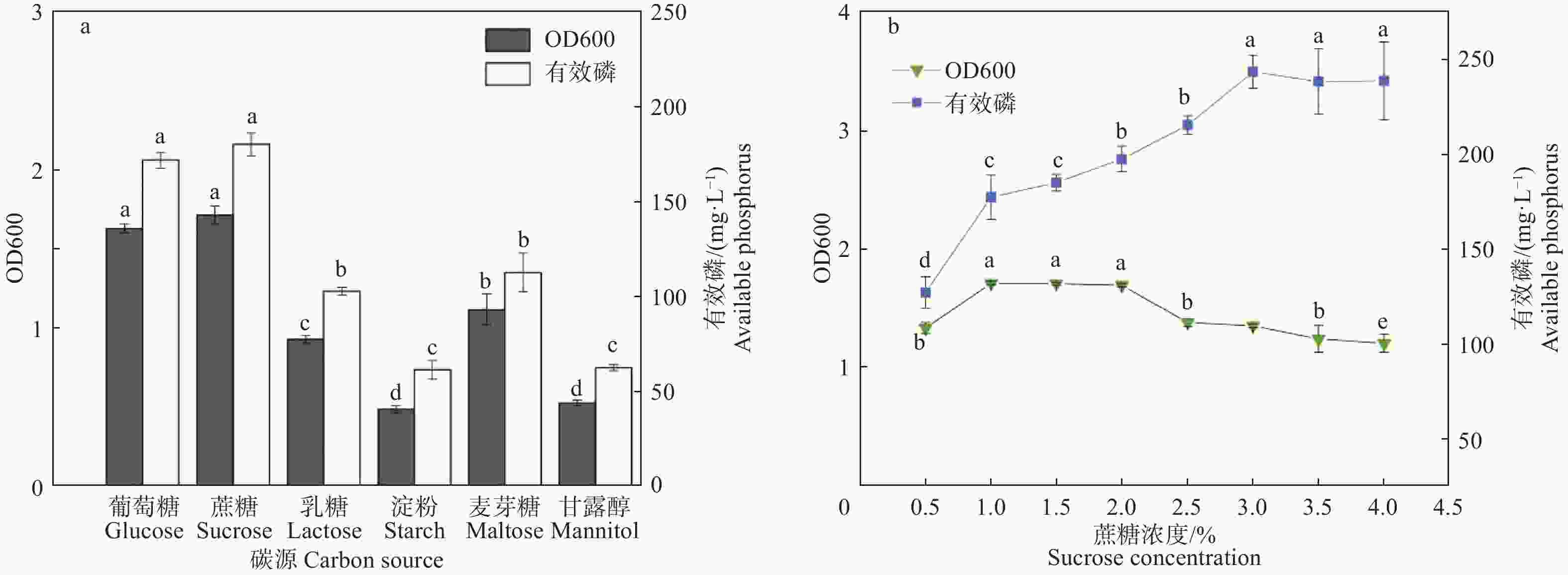
Figure 3. Phosphorus dissolving ability of P5 under different different carbon sources and sucrose concentrations
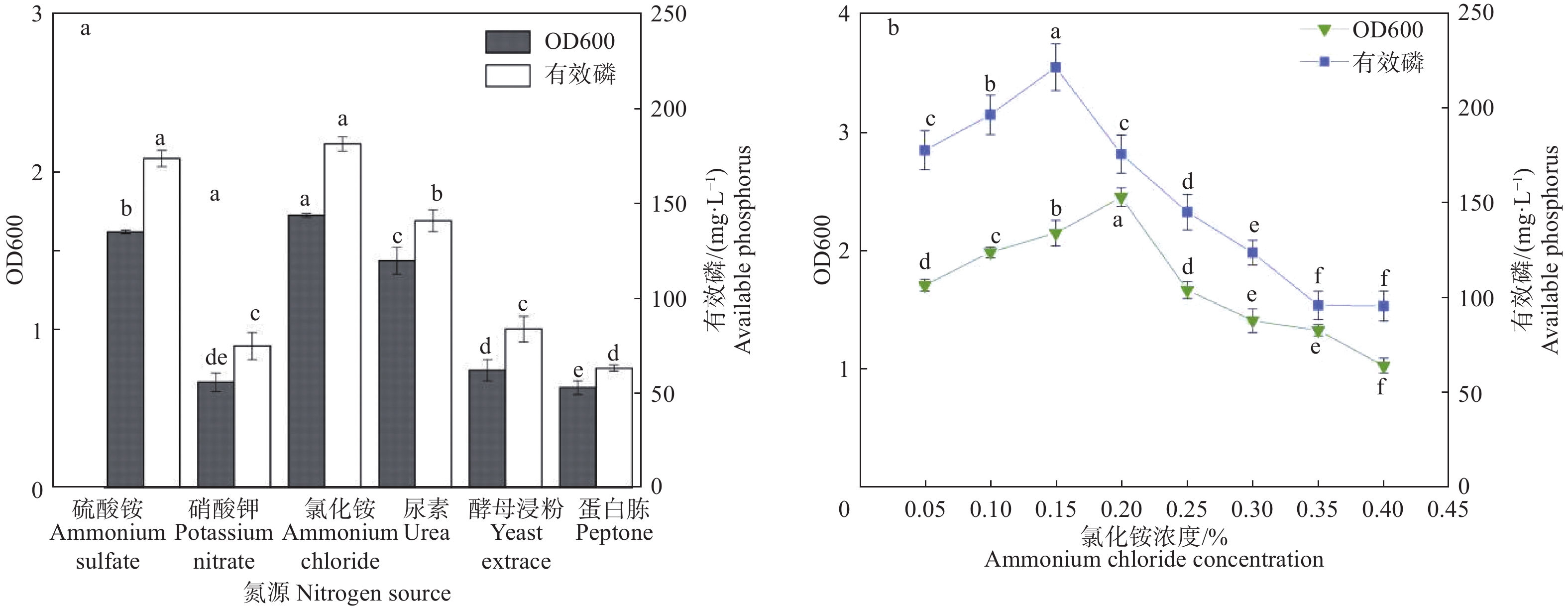
将不同氮源(硫酸铵、硝酸钾、氯化铵、尿素、蛋白胨、酵母浸粉)以0.05%(w/v)的浓度加入培养基中,测定不同氮源对有效磷含量的影响。如图4a所示,在以硫酸铵和氯化铵为氮源时,菌株P5有效磷含量显著高于其余4种氮源,其中氯化铵培养基中菌株生长量最高,是菌株P5溶解磷的最佳氮源。将氯化铵按0.05%~0.4%(w/v)范围内分8个浓度(梯度为0.05%)添加到培养基中,结果如图4b,浓度为0.15%时培养基中有效磷含量最高,高于或低于该浓度的培养基有效磷含量均减少。氯化铵浓度对菌株生长的影响与有效磷含量变化一致,氯化铵浓度为0.2%、0.15%时菌株生长量和有效磷含量分别达到最高值。

Figure 4. Phosphorus dissolving ability of P5 under different different nitrogen sources and ammonium chloride concentrations
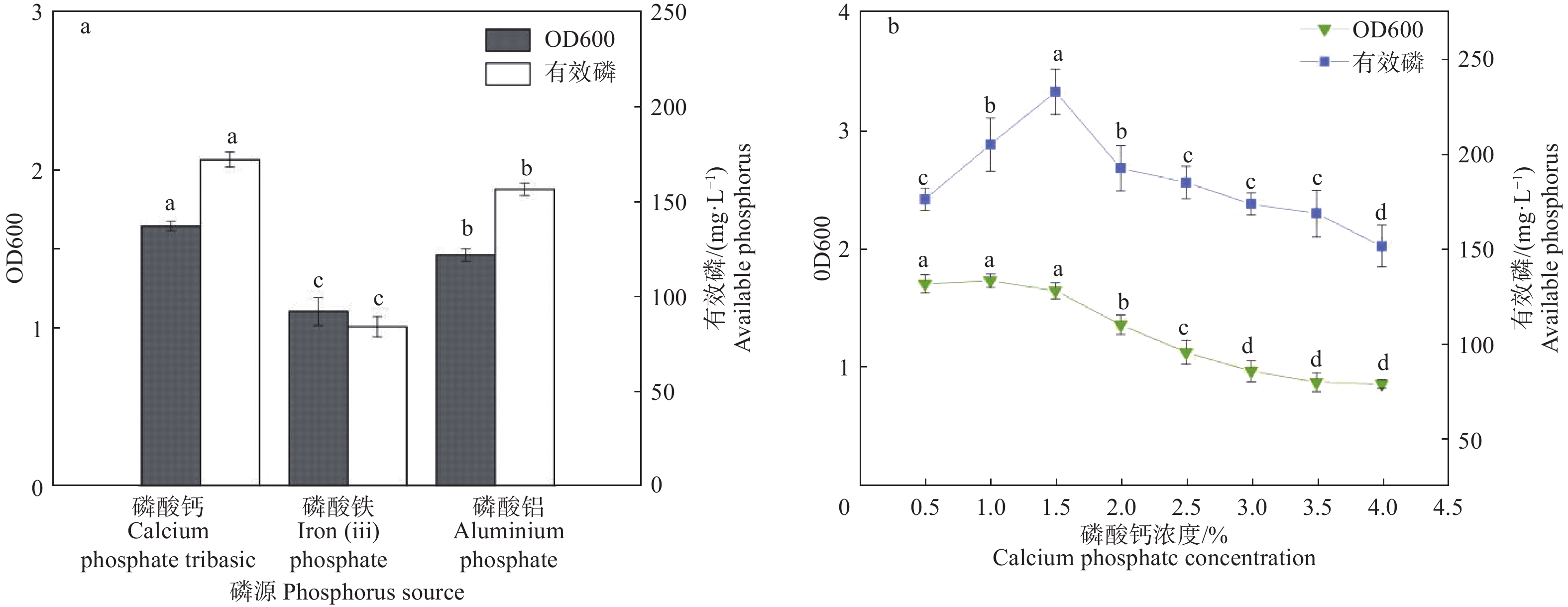
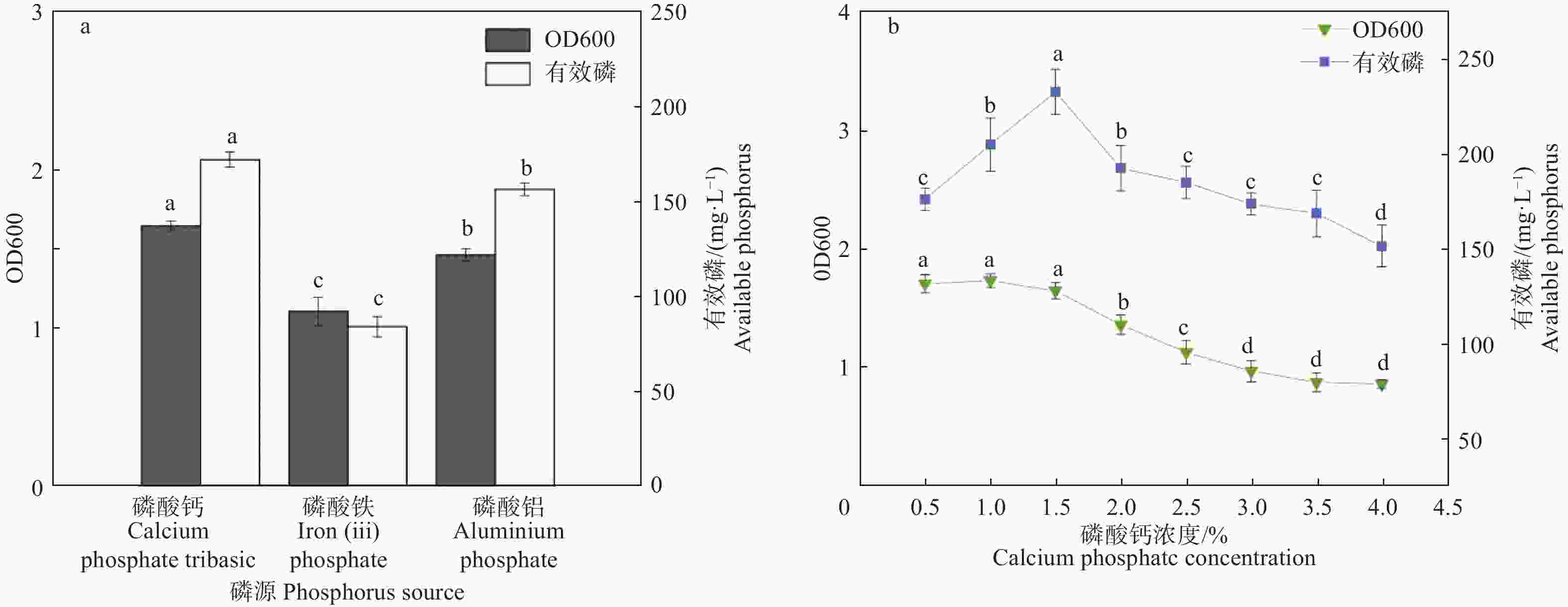
由图5a可知,3种不同磷源条件下,有效磷含量及菌株生长量大小排序为磷酸钙>磷酸铝>磷酸铁。在0.5%~4%(w/v)范围内分8个浓度(梯度为0.5%)将磷酸钙添加到培养基中,结果如图5b所示,菌株P5在0.5%~4%(w/v)范围内有效磷含量呈现先上升后下降的趋势,在1.5%浓度时有效磷含量达到最高。菌株生长量在浓度范围为0.5%~1.5%之间无明显变化,浓度增加至2%时菌株生长量显著减少。
-
在单因素试验的基础上,选择蔗糖、氯化铵、pH、温度进行四因素三水平正交试验。从表3和表4可知,因素B、C对菌株解磷能力影响显著(P<0.05),因素D极显著(P<0.01),因素A不显著,影响P5溶磷能力的因素主次顺序为D>B>C>A,即温度>氯化铵>pH>蔗糖。由表3可知,因素A、B、C、D优水平为A2、B3、C2、D2,优组合为A2B3C2D2。由于因素A的水平改变对试验结果几乎无影响,从经济角度考虑,选A1,因此培养条件优组合为A1B3C2D2,即蔗糖浓度为2.0%,氯化铵浓度为0.2%,pH为5.5,温度为30℃。为了验证该条件下P5溶磷能力,进行了补充试验,试验结果表明该条件下P5培养液中有效磷含量高达268.69 mg·L−1,显著高于优化前培养条件(PVK液体培养基),后者有效磷含量为195.61 mg·L−1。证明通过正交试验,调整后的培养条件更有利于提高菌株P5的溶磷能力。
序号
No.A蔗糖/%
SucroseB氯化铵/%
Ammonium chlorideC pH D温度/℃
Temperature有效磷P/(mg·L−1)
Available phosphorus1 1 1 1 1 219.82 2 1 2 2 2 247.66 3 1 3 3 3 229.82 4 2 1 2 3 235.35 5 2 2 3 1 215.25 6 2 3 1 2 255.35 7 3 1 3 2 229.82 8 3 2 1 3 208.77 9 3 3 2 1 239.12 K1 697.31 684.99 683.94 674.19 K2 705.95 671.68 722.13 732.88 K3 677.71 724.29 674.89 673.94 极差R 28.24 52.61 47.24 58.88 主次顺序 D>B>C>A 优水平 A2 B3 C2 D2 优组合 A2B3C2D2 Table 3. Results of the orthogonal test
方差来源
Source平方和
Sum of squares自由度
df均方
Mean squareF值
F-valueP值
P-valueA(蔗糖) 418.836 2 209.418 1.254 0.309 B(氯化铵) 1 496.670 2 748.335 4.480* 0.026 C(pH) 1 257.274 2 628.637 3.763* 0.043 D(温度) 2 301.778 2 1 150.889 6.889** 0.006 误差 Error 3 006.939 18 167.052 总计 Total 1 451 950.498 27 注:*表示在P<0.05水平差异显著,**表示在P<0.01水平差异显著。
Note: *Shows significantly differences at P<0.05. **Shows significantly differences at P<0.01.Table 4. Variance analysis of the orthogonal test
2.1. 溶磷能力测定
2.2. 菌株生理生化鉴定及16SrDNA序列分析
2.3. 培养条件优化
2.3.1. 菌株在不同碳源、氮源、磷源培养基中生长情况
2.3.2. 正交设计优化
-
从杉木人工林土壤中筛选到一株高效溶磷菌株P5,通过生理生化试验和16SrDNA基因序列分析鉴定为Burkholderia ubonensis。研究表明,随着培养时间的增加,菌株生长量先上升后下降,而有效磷含量上升到最高后保持平稳,可能是因为菌株生长达到了稳定期,菌体繁殖速度开始下降,但菌株分泌的代谢产物在这段时间内大量积累,促进了难溶性磷的溶解[16-17]。菌株P5生长最适pH范围为5~6,最适温度范围为25~30℃。杨艳红等[18]研究得出,芽孢杆菌的最适生长温度和pH分别为37℃、7.0;刘晓璐等[19]从烟草根际分离的功能菌最适生长温度为30℃,pH为7.5。研究表明,pH和温度通过影响微生物体内酶驱动过程而改变代谢速率,低温条件下菌株生长繁殖缓慢,活力下降,高温则容易导致菌体自溶[20]。接种量逐渐增加,菌株对空间和营养物质的争夺越强烈,导致细菌代谢速度逐渐减慢,代谢产物的累积速率减缓,从而导致有效磷含量减少,也可能是因为菌株生长过程产生了有毒代谢物质或细胞的自溶作用减缓了细菌代谢速率[21-22]。土壤pH值对林木生长有重要影响,极酸、极碱立地不利于林木生长,改良需要花费大量人力物力,且微生物肥料使用受限,土壤质量难以提高[23]。本研究筛选的P5菌株在4~10时均可生长,可在不同pH值土壤中应用。
本研究筛选的P5菌株的最佳碳源和氮源分别是蔗糖和氯化铵,而乔志伟等[24]分离的具有溶磷能力的伯克氏菌W4的适宜碳源、氮源分别为葡萄糖和硝酸钾。Park等[25]发现伯克氏菌Burkholderia vietnamiensi的最佳碳源和氮源分别是葡萄糖和尿素。其原因可能与微生物代谢机制的多样性以及不同碳、氮源的物理化学性质有关,不同碳源和氮源通过改变微生物代谢路径,导致其分泌的有机酸的种类和数量发生变化,从而改变了溶磷微生物的溶磷能力[26-29]。不同浓度碳源、氮源对不同菌株生长和溶磷效果影响不同,刘玉凤[28]等分离的假单胞菌的最适葡萄糖浓度为1%;Park等[25]研究发现葡萄糖浓度为3.5%时Burkholderia vietnamiensi的生长量最大,有效磷含量最高。本研究中蔗糖浓度为3%时,菌株生长量和有效磷达到最大值,此时菌株分泌大量有机酸,抑制了微生物的生长代谢,导致菌株生长量开始下降,培养液有效磷含量增加受限;氮源浓度高则引起微生物对磷的吸收增加,从而降低有效磷含量[30]。不同磷源对溶磷微生物的溶磷能力与难溶性磷酸盐的结构有关,本研究中菌株P5对磷酸钙的溶解效果最佳。菌株溶磷机制包括以下几种:分泌有机酸,呼吸酸化,NH4+同化,胞外酶水解[31-33]。Ca-P较易溶解可能与溶磷微生物分泌的有机酸种类有关,也可能是Ca-P的溶解是微生物分泌质子和有机酸螯合阳离子双重作用的结果,而Al-P和Fe-P只能通过螯合作用来释放磷酸盐[34-35]。磷源浓度也是影响溶磷微生物溶磷量的因素之一,磷浓度高,使微生物释放的磷再次被阳离子固定,形成难溶性磷酸盐,而低磷供应减少微生物蛋白质合成,降低微生物活性[36]。培养条件优化结果显示pH值对菌株溶磷量的影响极显著,温度、氮源对菌株溶磷量影响显著,这主要是因为菌株在不同培养条件下,基因调控及蛋白合成均会发生变化,从而引起菌株细胞膜通透性及对营养物质的吸收、菌株代谢产物及胞外酶活的变化[37-38]。然而,需要进一步研究以了解P5的溶磷机制,并在温室或田间条件下探索其促生能力及促生机制。
-
从杉木人工林土壤分离到1株耐酸,耐高温的高效溶磷细菌Burkholderia ubonensis P5。单因素试验表明P5最适培养时间为72~96 h,最适pH为5.0~7.0,最适温度在25℃~30℃之间,最适接种量为1.5%,最适碳源为蔗糖,氮源为氯化铵,磷源为碳酸钙。正交试验表明P5在蔗糖浓度为2.0%,氯化铵浓度为0.2%,pH为5.5,温度为30℃条件下溶磷能力显著提高。对菌株溶磷条件进行优化是有效发挥细菌溶磷能力的必要前提,为菌株P5的溶磷机制及其对植物生长的作用等后续研究奠定了基础。





 DownLoad:
DownLoad: