-
园林废弃物主要包括人工修剪的枝叶和草坪草、自然生长的杂草、自然掉落的枯枝落叶[1],其主要有机成分包括木质素、纤维素、半纤维素等[2]。随着生态文明建设的开展和城市绿化覆盖率的提高,城市中待处理的园林废弃物数量猛增,已成为城市第二大固体废弃物[3],2017年北京市年产园林废弃物已经达到600万吨[4]。堆肥处理等园林废弃物资源化利用是解决该问题的重要途径,堆肥处理可以将园林废弃物转化为有机肥料、栽培基质等产品,同时这些产品对提高土壤肥力、改善土壤物理结构[5]、促进植物生长[6]以及延缓土壤重金属污染等方面有重要作用[7]。有关堆肥的研究集中在调节C/N[8]、堆肥过程控制[9]及外源添加物改良园林废弃物堆肥品质[10]等方面;但园林废弃物堆肥木质素降解周期长、木质素降解率不高等问题依旧存在,如何加快木质素降解成为关键问题。木质素、纤维素及其二者的复合体是限制堆肥快速腐熟的关键因素,其中,木质素的影响作用尤甚[11]。漆酶、锰过氧化物酶[12]和木素过氧化物酶[13]是主要的降解酶类型,酶系对木质素降解的机理已有报道[14]。有研究表明,细菌、真菌对木质素的降解[15]及加速堆肥达到腐熟[16]都具有重要影响。木质素降解细菌的菌种筛选研究较多,然而,目前对木质素降解真菌的研究主要集中在白腐菌类,其他种属真菌的研究相对较少[17],菌种资源库亟待扩充。
本研究以北京地区收集的经过堆肥处理的园林废弃物为材料,从中筛选高效的木质素降解菌,对其进行分子生物学鉴定,并对其降解不同种类的园林废弃物效果进行研究,以期为提高园林废弃物利用率提供优质的菌株资源。
HTML
-
前期筛选目标菌株所用堆肥材料和后期模拟固态发酵材料均取自北京林业大学,包括冬青卫矛(Euonymus japonicas Thunb.)枝和叶、圆柏(Sabina chinensis (L.) Ant.)枝和叶及连翘(Forsythia suspensa (Thunb.) Vahl)枝叶。
-
马丁氏培养基、PDA固体培养基、PDA液体培养基[18]。
-
马铃薯浸提液1 L(取去皮马铃薯200 g,切成小块,加水1 L煮沸30 min,滤去马铃薯块,加蒸馏水将滤液补足至1 L),葡萄糖20 g,琼脂15 g,苯胺蓝0.1 g,自然pH。
-
马铃薯浸提液1 L(同1.2.1节)、葡萄糖20 g、琼脂15 g、愈创木酚0.1 mL,自然pH。
-
KH2PO4 1 g,MgSO4·7H2O 0.5 g,蛋白胨5 g,葡萄糖10 g,水1 000 mL,自然pH。
1.1. 园林绿化废弃物材料
1.2. 培养基
1.2.1. PDA-苯胺蓝培养基
1.2.2. PDA-愈创木酚培养基
1.2.3. 液体培养基
-
取1.0 g前期用于筛选菌株的园林废弃物堆肥材料,置于装有99 mL无菌水的250 mL三角瓶中,在180 r·min-1,28℃的条件下振荡30 min,使样品分散成均匀的悬液,悬液浓度为10-2 g·mL-1。取1 mL悬液进行梯度稀释,得到浓度分别为10-3、10-4、10-5、10-6 g·mL-1的稀释液,分别取每个浓度稀释液1 mL在马丁氏培养基上进行涂布培养,于恒温培养箱28℃培养3 d,根据菌落的形态指标(包括颜色、大小、边缘规整程度、表面纹饰)挑取不同的菌落,用接种针挑取后划线培养于PDA培养基中,经多次平板划线分离后,获得某一菌株的纯培养菌株。
-
分离得到的纯培养菌株以点接法分别接种到PDA-愈创木酚和PDA-苯胺蓝平板,设置3个重复,在35℃恒温培养箱中避光培养5 d,观察记录有无显色圈和褪色圈产生及其产生时间和直径大小,推断漆酶、锰过氧化物酶的产生情况,以此判断菌株是否具有木质素降解能力。
-
从上述具有木质素降解能力的菌株中选择一株单位时间内显色圈和褪色圈直径最大的菌株,进行ITS序列测序,将所得的ITS序列与Genbank中的核酸数据库序列进行Blast比对,采用MEGA 5.0软件包使用Neighbor-Joining法构建系统发育树[19]。
-
500 mL三角瓶中装入250 mL的PDA液体培养基,121℃下灭菌30 min,用接种针将纯培养的微生物从PDA固体培养基中转移至PDA液体培养基中,在180 r·min-1,28℃的条件下摇瓶培养,培养3 d后使用平板计数法记录真菌的群落数,当菌液浓度达到108 cfu·mL-1,则菌液配制完成。
-
为了更好模拟自然条件下堆肥过程,固态发酵试验中园林废弃物没有进行完全灭菌处理,即将用于固态发酵的园林废弃物仅于75℃连续烘干48 h。实际生产中由于连翘枝叶分离成本较高,一般不分开处理。因此,本研究中连翘枝叶未分开处理。圆柏与冬青卫矛的枝、叶分开粉碎,过20目筛。5个250 mL锥形瓶中分别装入过筛的5种园林废弃物物料(冬青卫矛枝、冬青卫矛叶、圆柏叶、圆柏枝、连翘枝叶)80 g,加入含0.6%硫酸铵的无菌水,使含水量达到60%,随后每组加入配置菌液10 mL,充分混匀后密封瓶口,置于25~30℃的培养箱中避光培养。固态发酵共40 d,于第1、3、5、7、9、11、13、15、18、21、25、30天取样1 g,加入无菌水以8 000 r·min-1,离心10 min,上清液即为粗酶液,用于测定漆酶、锰过氧化物酶酶活力。于第1、40天取样,用以测定木质素降解率,另以不加菌处理为对照。5个处理组和相对应的对照组实验均重复3次。
-
锰过氧化物酶采用Wariishi法进行活性测定,漆酶采用愈创木酚法进行活性测定[20]。
-
使用浓硫酸法测定木质素。离心管中放入待测样品,不加样品的空白处理为对照组,随后加入醋酸、乙醇乙醚混合液浸泡9 h,吸取上清液后水浴蒸干,加入浓硫酸静置16 h。加入氯化钡溶液处理,随后加入10%硫酸和重铬酸钾,沸水浴15 min,待冷却后加入碘化钾溶液、淀粉溶液,使用硫代硫酸钠滴定[21]。
-
使用EXCEL2016和SPSS16软件对处理前后木质素含量进行独立样本t检验,多重比较采用Duncan法(P < 0.05)对不同处理组的降解率提高值进行显著性分析。木质素降解率计算公式如下:
木质素绝对降解率提高值=(堆肥后对照组木质素含量-堆肥后处理组木质素含量)×100%
木质素相对降解率=(堆肥前木质素含量-堆肥后木质素含量)/堆肥前木质素含量×100%
相对降解率提高值=(处理T的相对降解率-对照CK的相对降解率)×100%
2.1. 菌株的富集纯培养
2.2. 木质素降解菌株的筛选
2.3. 木质素降解菌的种属鉴定
2.4. 配制菌液
2.5. 固态发酵实验
2.5.1. 木质素降解酶活性测定
2.5.2. 木质素测定方法
2.6. 数据处理方法
-
从经过堆肥处理的园林废弃物材料中共筛选出真菌18株,分别命名为菌株1~18。采用PDA-苯胺蓝平板显色法和PDA-愈创木酚平板褪色法筛选其中具有产生降解木质素相关降解酶能力的菌株。由表 1可看出:有4种真菌在愈创木酚培养基中产生了变色圈,8种真菌在苯胺蓝培养基中产生褪色圈,其中,2种真菌在2种平板中出现显色和褪色圈。愈创木酚培养基中产生变色圈说明真菌具有分泌锰过氧化物酶的能力,苯胺蓝培养基中产生褪色圈说明真菌具有产生漆酶的能力,菌株No.11和No.12可以同时分泌漆酶和锰过氧化物酶。图 1可见:菌株No.11在72 h内于苯胺蓝培养基中出现了褪色圈,且在愈创木酚培养基中出现了最大变色圈,因此,选取菌株No.11进行种属鉴定及后续研究。
菌株
strains愈创木酚显色时间
Culture time/h苯胺蓝褪色时间
Culture time/h24 48 72 24 48 72 菌株No.1 - - - + + + 菌株No.2 - - - + ++ ++ 菌株No.3 - + + - - - 菌株No.5 - - - + + + 菌株No.7 - - - + + + 菌株No.8 - + ++ - - - 菌株No.9 - - - - - + 菌株No.10 - - - - - + 菌株No.11 + ++ +++ + + + 菌株No.12 + + + + + + 注:-表示不显色(或不褪色);+、+ +、+ + +、+ + + +表示显色(或褪色)圈逐渐增大。
Note: “-” means no coloring (or no decoloring) zone; “+”, “+ +”, “+ + +”, “+ + + +” means bigger coloring (or bigger decoloring) zone gradually.Table 1. The coloring and decoloring results of different strains on selective mediums
-
菌株No.11在PDA培养基培养24 h的菌落为翠绿色(图 2),培养48 h后出现黄褐色,质地丝柔状,表面有黄褐色絮状颗粒结构。平、薄或具不明显的放射状沟纹。菌落反面近于无色或黄褐色。
-
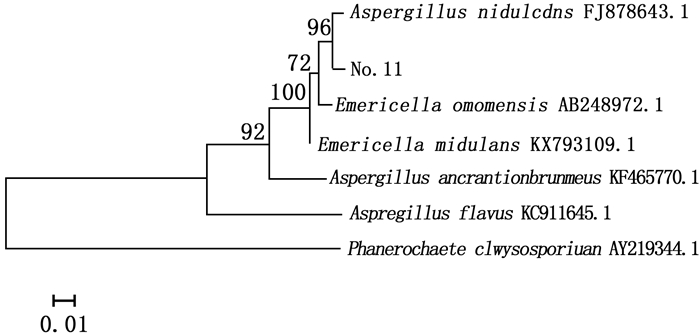
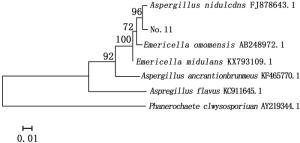
对菌株No.11进行ITS序列测序,测得菌株No.11的ITS序列与Genebank数据库中已注册的相应序列使用BLAST程序进行序列相似性比较分析,从比较结果中选取相似性为99%的已注册菌株,采用Mega5.0软件构建系统进化树图 3。
图 3显示:与菌株No.11同源性相似度较高的菌株属于曲霉属(Aspergillus sp.)和裸胞壳属(Emericella sp.),其中,同源性最高的为构巢曲霉(Aspergillus nidulans (Eidam) G.Winter),其次为Emericella omanensis Y. Horie & Udagawa。结合系统发育树及形态特征,最终确定菌株No.11为构巢曲霉。
-
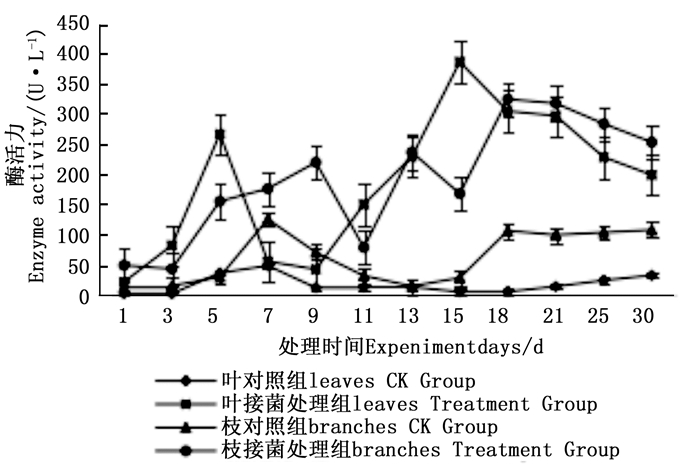
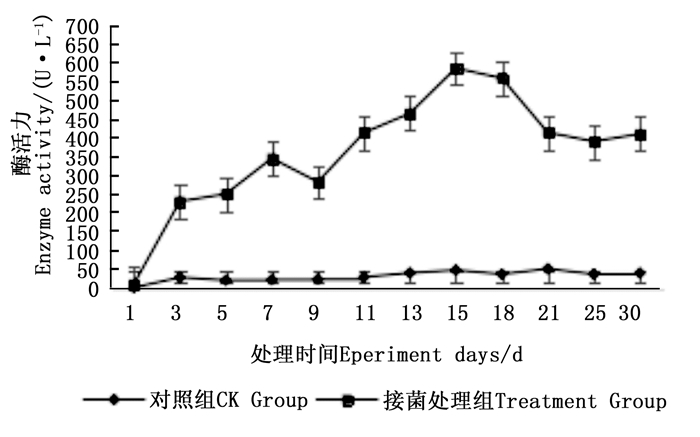
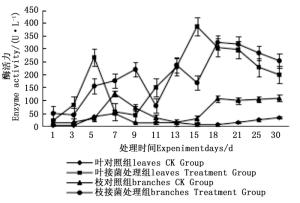
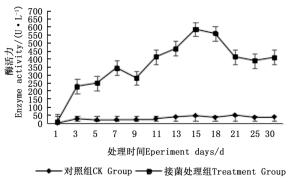
图 4~6表明:在固态发酵过程中,接菌处理的漆酶酶活力均高于对照,在固态发酵第3天,除连翘枝叶组外,其余4个接菌处理的漆酶酶活力仍处在较低水平。固态发酵第9天后,圆柏枝、冬青卫矛叶和连翘枝叶组漆酶酶活力开始逐渐升高。圆柏枝组在第13天漆酶酶活力到达峰值,为342.7 U·L-1。冬青卫矛叶和连翘枝叶组在第15天酶活力达到峰值,分别为388.7和588.5 U·L-1。冬青卫矛枝组和圆柏叶组在第18天酶活力达到峰值,分别为326.3和461.4 U·L-1。酶活性在一定程度上可以反应真菌对木质素的降解能力。分析原因在于,微生物从繁殖到代谢产酶需要一段时间,在固态发酵初始阶段漆酶酶活力较低,随着菌体生长及代谢旺盛,漆酶酶活力也逐渐达到高峰期。总体来看,以叶片为底物的固态发酵中的漆酶酶活力峰值高于以树枝为底物的接菌处理。可能的原因在于树枝中的木质素与纤维素、半纤维素相互结合形成木质纤维素,阻碍了微生物与木质素的接触,不利于木质素降解菌的利用[22]。
-
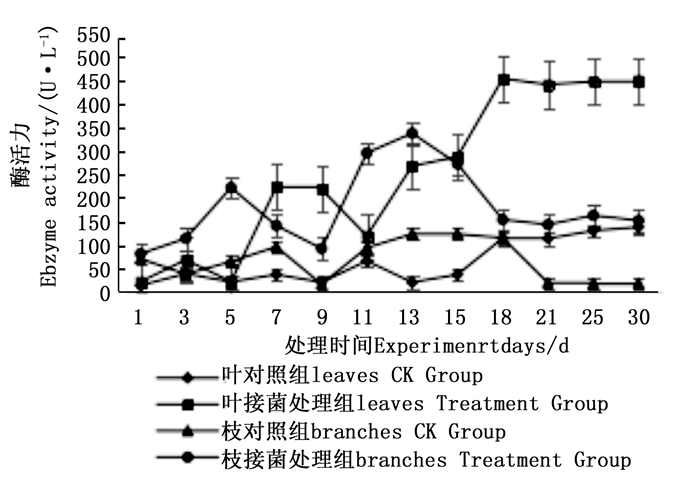
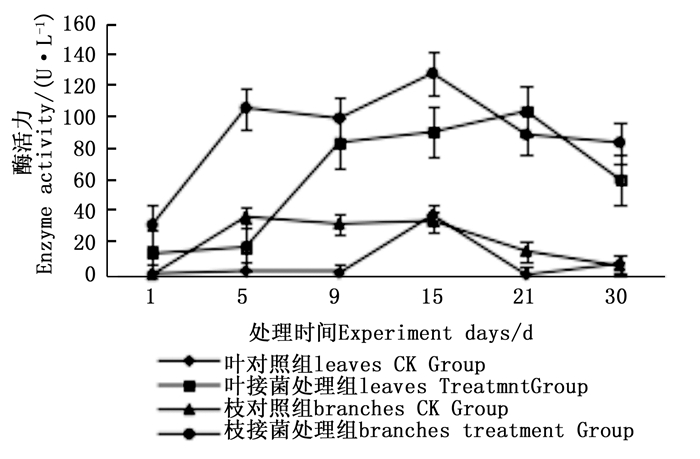
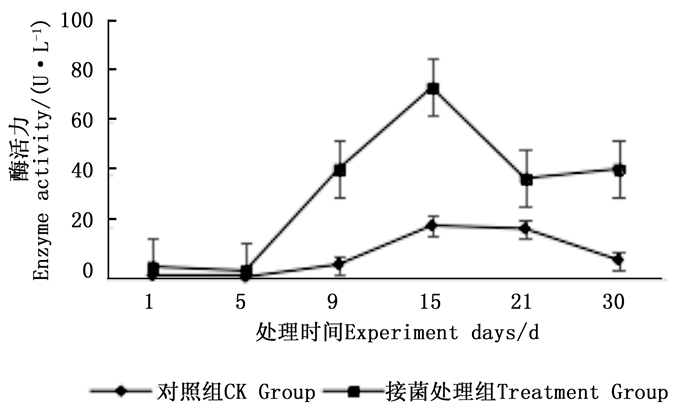
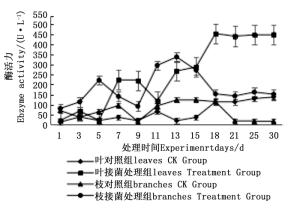
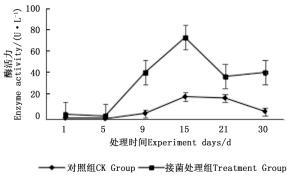
图 7~9表明:在固态发酵中,接菌处理组锰过氧化物酶酶活力均高于对照组,说明添加外源菌株在固态发酵中能够提高锰过氧化物酶的酶活力。固态发酵第5天,除圆柏枝接菌组锰过氧化物酶酶活力较之前有较高提升外,其他各组的酶活力仍处于较低水平。冬青卫矛叶组、连翘枝叶组第5天后酶活力开始逐渐升高,第15天酶活力达到峰值,分别为138.3、73.3 U·L-1。圆柏枝组在第15天酶活力达到峰值128.6 U·L-1。冬青卫矛枝组和圆柏叶组在第21天酶活力达到峰值,分别为121.1、104.6 U·L-1。接菌处理组锰过氧化物酶酶活力随时间的变化趋势和漆酶酶活力的变化趋势基本相近,说明二者的产酶期基本一致,但是从峰值与平均值看,各个接菌处理的锰过氧化物酶酶活力均低于漆酶酶活力,说明菌株主要通过分泌漆酶降解木质素,这与先前平板显色褪色实验得到结果吻合。
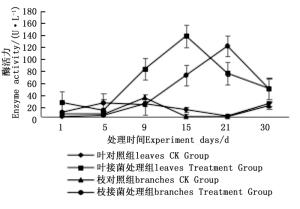
Figure 7. Changes in Manganese peroxidase activity of Euonymus japonicus branches and leaves during composting
-
在以不同园林废弃物为底物的固态发酵实验中,接种菌株No.11 40 d后各个接菌处理与对照组木质素降解率的测定结果见表 2。使用SPSS软件独立样本t检验分析得出:接种菌株No.11后,5种底物处理组与其对照组的木质素含量差异显著,菌株No.11显著降低了园林废弃物中木质素含量,降解木质素作用明显。以冬青卫矛叶为底物的固态发酵实验中,木质素相对降解率从模拟自然状态下的16.74%提高到了37.40%。冬青卫矛枝与圆柏枝对照组的模拟自然状态下的相对降解率分别为20.74%和23.03%,接菌处理的木质素相对降解率分别提升到43.59%和48.29%。在圆柏叶为底物的处理中,添加菌液对其木质素相对降解率提升效果最好,相对降解率提高值达到了29.90%。在连翘枝叶为底物的固态发酵中,木质素相对降解率从对照组的35.21%提高到52.17%。与冬青卫矛和圆柏的叶、枝对照、连翘枝叶对照相比,堆肥接菌处理的木质素含量分别减少了3.47%、4.90%、3.87%、8.22%、3.82%。多重比较结果表明,添加构巢曲霉对圆柏枝的处理效果与其他处理间差异显著,接菌处理对圆柏枝木质素绝对降解率有更明显的提升效果。对比添加菌液后各个处理组的木质素相对降解率提高值发现:添加菌液对圆柏枝与叶中木质素降解率的提升效果优于连翘枝叶,与冬青卫矛枝叶差异不显著。冬青卫矛枝叶和连翘枝叶的相对木质素降解率提高值间差异不显著,说明添加菌液对二者木质素的降解率提高效果相似。
试验材料
Experimental material处理
Treatment木质素含量
Lignin content/%绝对降解率提高值
Increment of absolute degradation rate/%相对降解率
Relative degradation rate/%相对降解率提高值
Increment of relative degradation rate/%堆肥处理前
Before composting堆肥处理后
After composting冬青卫矛叶Euonymus japonicus leaves 处理T 17.08±0.79 10.69±0.48A 3.47±0.69a 37.40±6.51 20.40±4.56ab 对照CK 14.17±0.51B 16.74±4.77 冬青卫矛枝 Euonymus japonicas branches 处理T 21.67±0.87 12.22±0.87A 4.90±1.62a 43.59±2.87 22.44±6.67abc 对照CK 17.12±0.93B 20.74±6.18 圆柏叶Sabina chinensis leaves 处理T 12.92±1.00 8.01±0.13A 3.87±0.56a 38.39±4.12 29.90±2.23c 对照CK 11.88±0.61B 8.12±5.19 圆柏枝 Sabina chinensis branches 处理T 32.50±0.33 16.81±1.27A 8.22±1.32b 48.29±2.26 25.28±3.84bc 对照CK 25.03±0.66B 23.03±4.43 连翘枝叶Forsythia suspensa branches and leaves 处理T 24.17±0.81 11.60±0.49A 3.82±0.45a 52.17±2.81 15.77±1.39a 对照CK 15.42±0.38B 35.21±3.64 注:同列不同大写字母表示同一试验材料内处理与对照组间差异显著,同列不同小写字母表示材料间差异显著(P < 0.05)。
Note: Different capital letters in same column mean significant difference between treatment and control among same material. Different lowercase letters in same column mean significant difference among those materials(P < 0.05).Table 2. Variation of lignin content and degradation rate during simulated composting with different substrates
3.1. 木质素降解菌的筛选
3.2. 菌株No.11的菌种鉴定结果
3.2.1. 菌株No.11的形态特征
3.2.2. 菌株No.11的ITS序列分析及系统发育树的构建
3.3. 菌株No.11对5种底物中木质素的降解作用
3.3.1. 木质素降解酶酶活力的变化
3.3.1.1. 漆酶酶活力变化
3.3.1.2. 锰过氧化物酶酶活力变化
3.3.2. 木质素含量变化
-
固体发酵堆肥是农林牧业废弃物资源化利用的重要方式,除了调控堆体温度、C/N等技术参数外,外加微生物也是调控堆肥化过程的措施之一。园林废弃物与农业废弃物(如畜禽粪便、农作物废弃物)相比,园林废弃物拥有更高的木质素含量,更难降解。目前,市场现有菌剂中所利用的微生物多为从农业堆肥体系中筛选,缺乏来自园林废弃物堆肥体系针对高木质素废弃物的微生物菌种。前人进行了大量筛选木质素降解微生物的研究,筛选出的菌种除细菌外[23],真菌研究集中于担子菌纲中的白腐菌,如尹立伟等[24]研究了属于白腐菌类的药用菌灰树花对木质素的降解能力,但对子囊菌纲中曲霉属真菌在木质素降解方面的研究有限。习兴梅等[25]利用选择平板筛选法从农业废弃物稻草堆肥中筛选出曲霉属真菌黑曲霉(Aspergillus niger Tiegh),结果表明,黑曲霉具有木质素降解能力,且主要依靠漆酶、过氧化物酶、锰过氧化物酶、木聚糖酶降解木质素。本研究利用相同方法从园林废弃物处理物中筛选出多株分泌漆酶或锰过氧化物酶的真菌,显色褪色结果显示菌株No.11的产酶效率更高,使用ITS测序构建系统发育树,鉴定菌株No.11为曲霉属构巢曲霉。
在固态发酵前期,漆酶和锰过氧化物酶酶活力较低;随着微生物菌落增多,代谢开始旺盛,漆酶与锰过氧化物酶酶活力也逐渐上升。在堆肥第15~18天酶活力到达峰值。陈建军等[26]从秸秆及造纸厂废水中筛选出黄孢原毛平革菌,其漆酶活性最高值仅为233.3 U·L-1,而本研究筛选的菌株漆酶酶活力峰值为588.5 U·L-1,有更强的产酶能力。张年磊[27]从造纸废水污泥中筛选出同为曲霉属的真菌Aspergillus sp. F-1,应用于造纸废水因高木质素所导致高色度及高COD等问题的处理,木质素降解率提高了20%~40%,与本研究结果相近,即构巢曲霉使堆肥中圆柏枝叶等园林废弃物的木质素降解率提高了15%~30%,筛选出的曲霉属真菌对于木质素降解率有较好的提升效果。
在实际处理中,园林废弃物的枝与叶通常分开处理,为了更好模拟自然条件下的堆肥过程,固态发酵中园林废弃物没有进行彻底的灭菌处理(仅为75℃连续烘干48 h),同时明确了发酵底物的组成成分。结果表明,构巢曲霉对园林废弃物中的木质素表现出了较强的降解能力。圆柏及冬青卫矛枝与叶间的木质素降解率提高值差异不显著,该种曲霉对提高植物枝、叶的木质素降解率效果相似。绝对降解率提高值表明接菌处理对于圆柏枝的提升效果最明显,可能是因为圆柏枝初始的木质素含量较高,反应底物充足有利于微生物繁殖。从木质素相对降解率提高值看,构巢曲霉提高乔木枝叶木质素降解的能力可能优于灌木,但这仍需进一步研究验证。综合绝对、相对降解率提高值,构巢曲霉对圆柏枝和叶的木质素降解率提高效果更明显。
目前,堆肥中微生物添加剂的研制还处于实验室阶段,距离真正用于生产实践还存在一定的差距。主要问题在于实际生产的环境条件更加复杂[28],堆体中的微生物类群十分庞大[29],菌剂中的微生物很难占据良好的生态位,形成优势群落。曲霉的优势在于繁殖迅速,可以在一定程度上解决这个问题。通过初步考察该菌降解木质素的能力, 为后续研究复合菌剂的制备及大规模工厂化生产奠定基础。
-
从经过堆肥处理的园林废弃物中筛选出1株高效木质素降解菌株No.11。通过形态观察和ITS序列分析,菌株No.11鉴定为构巢曲霉,可用于探究真菌降解木质素原理和生产木质素降解菌剂。
构巢曲霉对于北京常见绿化园林树种所产生的园林废弃物中木质素降解效果较好,以冬青卫矛叶、冬青卫矛枝、圆柏叶、圆柏枝、连翘枝叶为底物的固态发酵中漆酶酶活力峰值分别为388.7、326.3、461.4、342.7、588.5 U·L-1,锰过氧化物酶的酶活力峰值分别为138.3、121.1、104.6、128.6、73.3 U·L-1。添加构巢曲霉使冬青卫矛叶、冬青卫矛枝、圆柏叶、圆柏枝、连翘枝叶40 d后木质素降解率分别提高了20.40%、22.44%、29.90%、25.28%、15.77%。








 DownLoad:
DownLoad: